حلال و حل شونده در شیمی | به زبان ساده

ماده شیمیایی موجود در یک محلول را میتوان به دو دسته حلال و حل شونده تقسیم کرد. «حلال» (Solvent) به ماده شیمیایی میگویند که مقدار بیشتری از آن در محلول وجود داشته باشد و بنابراین مادهای است که سایر مواد شیمیایی در آن توزیع یا حل شدهاند. «حلشونده» (Solute) نیز به ماده شیمیایی میگویند که نسبت به حلال مقدار کمتری داشته و به شکل یکسان در محلول توزیع شده باشد. در این مطلب قصد داریم در رابطه با مفاهیم حلال و حل شونده در شیمی صحبت کنیم و تعریف مختصری از محلولها داشته باشیم.
تعریف حلال و حل شونده
همانطور که گفته شد، در یک محلول به جزء با مقدار بیشتر، حلال و به جزء با مقدار کمتر، حلشونده میگویند و این ماده به شکلی یکنواخت (همگن) در حلال توزیع (حل) شده است. بر اساس این تعریف، در یک محلول، تنها یک ماده شیمیایی را میتوان به عنوان حلال در نظر گرفت. بنابراین، اگر تنها دو ماده شیمیایی در یک محلول وجود داشته باشند، یکی حلال و دیگری حلشونده خواهد بود. اگر یک محلول شامل ۳ یا چند ماده شیمیایی باشد، یک ماده را باید به عنوان حلال مشخص کرد و مابقی مواد نیز حلشونده خواهند بود.
رفتارهای کمی و سنجشهای کیفی یک محلول به حلال و حل شونده موجود در یک محلول بستگی دارند. بنابراین، برای فهم و بکارگیری مفاهیم مرتبط با محلولها در شیمی، هر ماده موجود در محلول را باید در ابتدا به حلال و حل شونده تقسیم کرد.
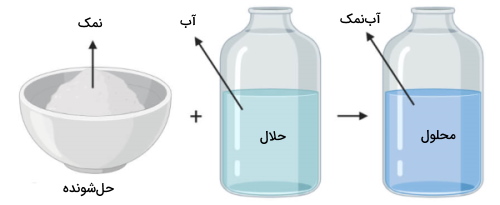
نحوه تشکیل محلول ها
یک محلول زمانی شکل میگیرد که مادهای در ماده دیگری حل شود و دیدیم که مادهای که با مقدار کمتر وجود دارد، حلشونده نام دارد که در حلال، حل میشود. در مثالی دیگر، اگر دو فلز مس و قلع را ذوب و در یکدیگر حل کنیم، نوعی محلول به نام برنز بدست میآید که به آلیاژ برنز معروف است. از آنجایی برنز، بیشتر از مس تشکیل شده است، مس را حلال و قلع را حلشونده مینامیم. همانطور که گفتیم، این دو فلز در حالت مذاب با یکدیگر مخلوط شدند اما در دمای اتاق، محلولی جامد خواهیم داشت.
حالت مواد حلال و حل شونده
در مثال برنز، یک جامد (قلع) در جامدی دیگر (مس) حل شده بود. با این وجود، مواد در حالتهای مختلف میتوانند نقش حلال و حل شونده داشته باشند. به طور مثال در محلول آبنمک، یک جامد (نمک) در مایع (آب) حل شده است. در جدول زیر مثالهایی از حلال و حل شونده در حالتهای مختلف آورده شده است.
| حلال | حلشونده | نوع انحلال - نوع محلول |
| نیتروژن | اکسیژن | انحلال گاز در گاز - هوای خشک |
| آب | دیاکسید کربن | انحلال گاز در مایع - آب گازدار |
| هوا | آب | انحلال مایع در گاز - هوای مرطوب |
| آب | استیک اسید | انحلال مایع در مایع - سرکه |
| چای | شکر | انحلال جامد در مایع - چای شیرین |
حلال و حل شونده هوا
اگر با اجزای تشکیل دهنده هوا آشنایی داشته باشید میدانید که هوا مخلوطی از نیتروژن، اکسیژن و چندین گاز دیگر است که یک محلول را تشکیل میدهند. با توجه به اینکه در حدود ۷۸ درصد از هوا را نیتروژن تشکیل میدهد، این گاز را میتوان به عنوان حلال و بقیه گازها از جلمه اکسیژن را به عنوان حلشونده در نظر گرفت.
نقش آب به عنوان حلال
توجه داشته باشید که نمک تنها جامدی نیست که در آب حل میشود. در حقیقت بسیاری از مواد دیگر نیز قابلیت انحلال در آب دارند به گونهای که از آب به عنوان یک حلال همهکاره در شیمی نام میبرند. خاصیت خوب آب به عنوان حلال از آنجایی شکل میگیرد که این ماده، ترکیبی بسیار قطبی است. یک ترکیب قطبی دو سر باردار مثبت و منفی را شامل میشود. حلشوندههایی هم که باردار باشند به قطبهای باردار مولکول آب جذب میشوند. این امر سبب میشود تا مولکولهای آب، ذرات حلشونده را از یکدیگر جدا کنند.
در طرف دیگر، موادی وجود دارند که در آب حل نمیشوند. حتما برای شما پیش آمده است که بخواهید لکه روغنی را از روی دیوار یا لباس پاک کنید اما نتوانید این کار را به کمک آب انجام دهید زیرا روغنها مولکولهایی ناقطبی هستند و بنابراین، دارای ذراتی باردار نیستند و نمیتوان آنها را در آب حل کرد.
شبیه شبیه را در خود حل میکند
همانطور که گفته شد برای پاک کردن لکه روغن نمیتوان از آب به تنهایی استفاده کرد چراکه روغن، ترکیبی ناقطبی بود. عبارت «شبیه، شبیه را در خود حل میکند» به این نکته اشاره دارد که ترکیبات قطبی در یکدیگر حل میشوند و به طور مشابه نیز ترکیبات ناقطبی با یکدیگر امتزاجپذیرند.
حل شونده های یونی و کووالانسی
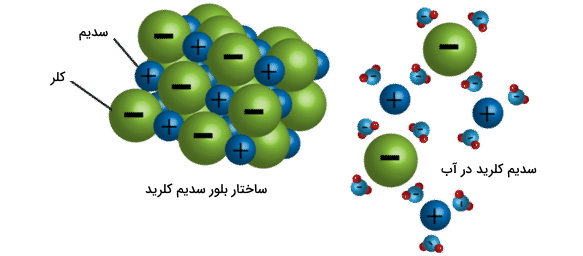
تمامی حلشوندهها زمانیکه در حلال خود حل شوند، به ذراتی مجزا تبدیل خواهند شد اما این ذرات در ترکیبات یونی و کووالانسی متفاوت خواهند بود. حلشوندههای یونی به یونهای مجزا تبدیل (تفکیک) و حل شوندههای کووالانسی به مولکولهای مجزا تبدیل میشوند. نمک طعام (سدیم کلرید) یک ترکیب یونی است. در تصویر زیر، نحوه انحلال سدیم کلرید در آب نشان داده شده است. همانطور که مشاهده میکنید، سر منفی مولکولهای آب جذب یونهای مثبت سدیم و سر مثبت مولکول آب (هیدروژن) جذب یونهای منفی کلر میشوند. این نیروهای جاذبه سبب تفکیک یونها از یکدیگر خواهند شد.
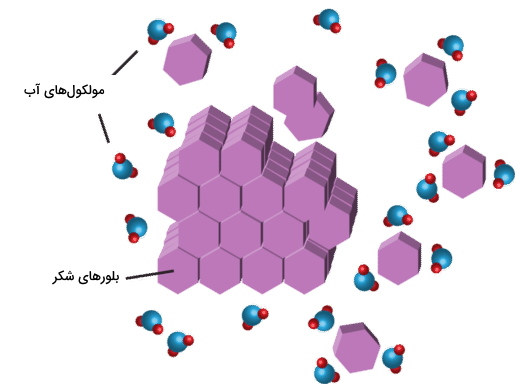
شکر (گلوکز) نوعی ترکیب کووالانسی است. زمانیکه شکر در آب حل شود، مولکولهای مجزای گلوکز $$(C_6 H _ {12} O _ 6)$$ تشکیل خواهند شد. شکر مانند آب، قطبی است و بنابراین مولکولهای شکر نیز دارای دو سر مثبت و منفی هستند. نیروهای جاذبه بین بارهای مخالف در مولکولهای آب و شکر سبب جدایش مولکولهای شکر از بلور آن و بعد از مدتی مولکولهای شکر از بلور خود جدا و توسط مولکولهای آب احاطه میشوند.
معرفی فیلم آموزش محلول سازی در آزمایشگاه
از آنجایی که در آزمایشگاههای شیمی، تهیه محلولها بخشی جداییناپذیر از فعالیتهای آزمایشگاهی به شمار میآید، فرادرس اقدام به انتشار فیلم آموزش محلول سازی در آزمایشگاه در قالب آموزشی ۲ ساعت ۵۰ دقیقهای با ۹ درس کرده است که در ادامه به بررسی دروس این دوره خواهیم پرداخت. این آموزش برای کلیه دانشجویان، دانشآموزان و علاقهمندان به علم شیمی مناسب است زیرا نحوه ساخت انواع محلولها را در این دوره یاد میگیرند.
درس اول این آموزش به تعاریف پایهای از جمله تعریف حلال و حل شونده و همچنین جرم مولی اختصاص دارد و در درس دوم نحوه بکارگیری استوکیومتری در محلولسازی مورد بررسی قرار میگیرد و مفاهیمی همچون مولاریته و نرمالیته مرور میشوند. در درس سوم مراحل اصلی در محلولسازی به همراه تجهیزات آزمایشگاهی مورد نیاز بیان خواهد شد. درس چهارم و پنجم به محلولسازی از جامدات معدنی و اسیدهای تجاری اختصاص دارد. تهیه محلول بازی و محلول بافر در درسهای ششم و هفتم آموزش داده میشود. نحوه ساخت معرفهای پرکاربرد و مفاهیم پیشرفته در محلولسازی نیز در دو درس انتهایی مورد بررسی قرار میگیرند.
بررسی دقیق تر حلال و حل شونده
همانطور که گفته شد، نوع حلال و حل شونده در محلول را میتوان به کمک مقدار نسبی آنها نیز مشخص کرد. توجه داشته باشید که مقدار ماده شیمیایی موجود در یک محلول را میتوان با واحدهای مختلفی بیان کرد که برخی از آنها در زیر فهرست شدهاند.
البته برای مقایسه کمی مقادیر در یک مساله باید تمامی آنها به یک واحد تبدیل شوند. بنابراین، اگر از واحدهای مختلفی برای بیان مقدار ماده شیمیایی موجود استفاده شود باید از ضرایب تبدیل مناسب و استوکیومتری بهره برد. در ادامه، مثالی را برای درک بهتر مقادیر حلال و حل شونده در یک محلول مورد بررسی قرار میدهیم.
مثال حلال و حل شونده
مقدار حلال و حل شونده در یک محلول را مشخص کنید که در آن، ۲۸/۴۷ گرم سدیم کلرید با ۱۴۷/۲ میلیلیتر آب مخلوط شده است.
پیش از انجام محاسبات میدانیم که حلال و حل شونده به ترتیب آب و سدیم کلرید هستند اما نحوه حل این مثال را میتوان برای سایر مواد در یک محلول نیز مورد بررسی قرار داد. روش کلی به این شکل است که مقادیر نسبی سدیم کلرید $$(NaCl)$$ و آب را با یکدیگر مقایسه میکنیم تا حلال و حل شونده مشخص شوند.
واحدهای ذکر شده در سوال به ترتیب گرم و میلیلیتر هستند. با وجود اینکه هر دو واحد برای ذکر مقدار یک ماده شیمیایی، واحدی قابل قبول به شمار میآیند اما برای مقایسه، این دو واحد باید با یکدیگر برابر باشند. بنابراین، یکی از آنها را باید به دیگری تبدیل کرد. روش مستقیم و ساده برای این کار استفاده از چگالی آب با مقدار $$1\ g/mL$$ یا $$1\ g/cm ^ 3$$ است. با وجود اینکه هر دو واحد ذکر شده معادل یکدیگر هستند از واحد اول برای حل این مثال استفاده میکنیم چراکه این واحد شامل عبارت میلیلیتر و گرم است که کار تبدیل واحد و مقایسه با نمک را ساده میکند.
نحوه محاسبه و استفاده از ضرایب تبدیل در زیر آورده شده است.
$$\begin{equation}
\begin{array}{c}
\require {cancel}
\mathrm{d}=\frac{\mathrm{m}}{\mathrm{V}} \\
1.00 \mathrm{~g} / \mathrm{mL}=\frac{\mathrm{m}}{147.2 \mathrm{~mL}} \\
\frac{1.00 \mathrm{~g}}{\mathrm{~mL}}=\frac{\mathrm{m}}{147.2 \mathrm{~mL}} \\
(1.00 \mathrm{~g})(147.2 \mathrm{~mL})=(\mathrm{m})(\mathrm{mL}) \\
\mathrm{m}=\frac{(1.00 \mathrm{~g})(147.2 \cancel { \mathrm{mL}})}{(\cancel {\mathrm{mL}} )}\\
\mathrm{m}=147.2 \mathrm{~g}
\end{array}
\end{equation}
$$
البته شکل سادهتری نیز برای محاسبه جرم آب وجود داشت. با توجه به اینکه چگالی آب برابر با ۱ گرم بر میلیلیتر است یعنی هر میلیلیتر آب معادل ۱ گرم است و بنابراین اگر ۱۴۷/2 میلیلیتر آب داشته باشیم معادل 147/2 گرم خواهد بود. فارغ از نوع روش محاسبه، در نهایت میتوانیم جرم آب و شکر را با یکدیگر مقایسه کنیم تا نوع حلال و حل شونده در محلول حاصل مشخص شود. میبینیم که جرم آب، بسیار بیشتر از جرم نمک است و بنابراین، حلال و حل شونده به ترتیب، آب و نمک هستند.











ممنون از اطلاعات جامع و ارزندتون.من میخوام یک پور ویتامینه که غالبا در آب حل میشه رو در روغن خوراکی حل کنم میتونین منو راهنمایی بفرمایین.ممتون میشم
درود و سپاس
البته در مثال آبنمک، نمک در آب حل نمیشه بلکه با آب ترکیب میشه (یک اتفاق شیمیایی). در صورتیکه مثلاً در محلول آب و شکر، شکر در آب حل میشه (یک اتفاق فیزیکی)
در نتیجه مفاهیمی مثل انحلال و محلول و حلال و حلشونده برای تغییرات فیزیکی هستند.
سلام یه سوالی داشتم
حل شونده و حلال در محلول ید رو میگید؟
با سلام؛
نحوه انحلال ترکیبات یونی و کووالانسی به طور کامل در مطلب توضیح داده شده است. با این وجود، برای آشنایی بیشتر با تغییرات فیزیکی و شیمیایی، مطالعه مطالب زیر پیشنهاد میشود.
تغییر فیزیکی و مثالهای آن — به زبان ساده (+ دانلود فیلم آموزش رایگان)
تغییر شیمیایی و مثالهای آن — به زبان ساده (+ دانلود فیلم آموزش رایگان)
با تشکر