تفاوت دفاع اختصاصی و غیر اختصاصی چیست؟ — به زبان ساده

دفاع اختصاصی و غیراختصاصی دو مکانیسم سیستم ایمنی برای محافظت از بدن انسان در برابر باکتریها، قارچها، انگلها، ویروسها، آغازیان بیماریزا و پیشگیری از گسترش سلولهای توموری است. سلولهای ایمنی متفاوتی با مکانیسمهای متنوع در این دو بخش سیستم ایمنی بدن شرکت میکنند. در این مطلب تفاوت دفاع اختصاصی و غیر اختصاصی در نوع سلولهای ایمنی و روشهای ایجاد پاسخ را توضیح میدهیم.
تفاوت دفاع اختصاصی و غیر اختصاصی بدن چیست ؟
بدن انسان روزانه با میلیونها میکروب و عامل بیماریزای متفاوت در ارتباط است. اما برای جلوگیری از ورود، رشد و انتقال این میکروبها به بخشهای مختلف، مکانیسمهای بسیار تخصص یافتهای در بدن وجود دارد. دفاع اختصاصی و غیر اختصاصی دو مکانیسم اصلی بدن برای محافظت از ما در برابر عوامل بیماریزا هستند. دفاع غیراختصاصی از مجموعه فرایندهای زیستی تشکیل میشود که بلافاصله پس از ورود عامل بیماریزا فعال میشوند یا مثل پوست از قبل در بدن وجود دارند و از ورود میکروبها به بخشهای داخلی جلوگیری میکنند. این مکانیسمها وابسته به نوع عامل بیماریزا نیستند و فقط بیماریزا بودن عامل خارجی برای فعال شدن سیستم ایمنی کافی است. برای مثال پاسخ دفاع غیراختصاصی به عامل بیماری کزاز، سرماخوردگی یا ویروس کرونا متفاوت نیست. اما مکانیسمهای دفاع اختصاصی وابسته به نوع عامل بیماریزا طراحی میشود و برای هر بیماریها نوع مشخصی پادتن یا آنتیبادی تولید میکند.
تفاوت سلول های ایمنی دفاع اختصاصی و غیر اختصاصی چیست ؟
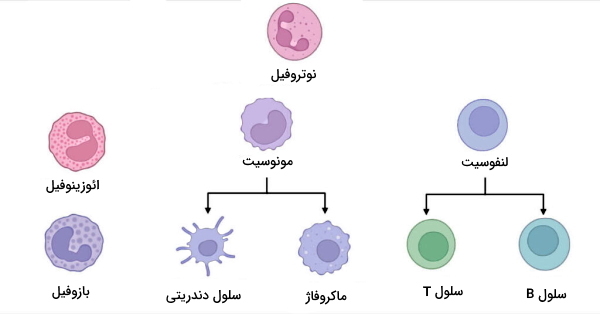
گلبولهای سفید یا «لوکوسیتها» (Leukocytes) سلولهای خونی هستند که وظیفه دفاع اختصاصی و غیراختصاصی بدن را بر عهده دارند. این سلولها از تمایز سلولهای بنیادی (سلولهای خونساز) یکسان در مغز قرمز استخوان ایجاد میشوند اما شکل، وظیفه و مسیر تمایز آنها متفاوت است. گرانولوسیتها و آگرالونوسیتها، گلبولهای سفید دفاع غیراختصاصی و لنفوسیتها، گلبولهای سفید دفاع اختصاصی بدن هستند. یک تفاوت دفاع اختصاصی و غیر اختصاصی گلبولهای سفید شرکتکننده در هر یک از آنها است.
گلبول های سفید دفاع غیر اختصاصی
گلبولهای سفید دفاع غیراختصاصی را میتوان بر اساس شکل سیتوپلاسم پس از رنگآمیزی سلولها تقسیمبندی کرد. در سیتوپلاسم گرانولوسیتها تعداد زیادی وزیکول حاوی آنزیمها، پروتئینها و ترکیبات شیمیایی ضدمیکروبی وجود دارد. به همین دلیل سیتوپلاسم این سلولها پس از رنگآمیزی و زیر میکروسکوب به شکل دانهدانه یا گرانولی دیده میشود و به آنها گرانولوسیت میگویند. اما این وزیکولها در سیتوپلاسم آگرانولوسیتها وجود ندارد. آ یا A پیشوندی در زیستشناسی به معنی نبودن یک ویژگی است. نوتروفیل، ائوزینوفیل و بازوفیل گرانولوسیتهای دفاع غیراختصاصی و مونوسیتها، آگرانولوسیتهای دفاع غیراختصاصی بدن هستند.
نوتروفیل
نوتروفیلها اولین سلولهای ایمنی خون هستند که در دفاع غیراختصاصی بدن شرکت میکنند. شکل این سلولها در حالت استراحت و نبود عامل بیماریزا در بدن کروی و قطر آنها بین ۱۲ تا ۱۴ میکرومتر است. هسته این گلبول سفید از چند بخش یا لوب (سه تا پنج) تشکیل شده است که با رشتههای کروماتینی نازک به هم متصل میشوند. علاوه بر هسته و وزیکولهای ذخیرهای، اندامکهای گلژی، میتوکندری و ریبوزوم در سیتوپلاسم این سلولها وجود دارد. تعداد نوتروفیلها از سایر گلبولهای سفید در خون بیشتر و حدود ۶۲٪ کل سلولهای ایمنی خون است.
طول عمر این سلولها بر اساس وضعیت بدن بین ۵ تا ۱۳۵ ساعت تغییر میکند. در زمان حضور عامل بیماریزا و عفونت نوتروفیلها شبیه آمیب شده و سلول با تشکیل پاهای کاذب و فرایند دیاپدز از غشای مویرگهای خونی عبور میکند تا به محل عفونت در بافت برسد. نوتروفیلها با سه مکانیسم فاگوسیتوز، ترشح مواد ضدمیکروبی و تشکیل دام خارج سلولی در دفاع غیراختصاصی بدن شرکت میکند. این سلولهای ایمنی پس از فاگوسیتوز میکروبها از بین میروند و بخشی از چرک زخم را ایجاد میکنند.
ائوزینوفیل
ائوزینوفیلها گروه دیگری از سلولهای ایمنی دفاع غیراختصاصی بدن هستند. اندازه این سلولها (قطر ۱۲ تا ۱۷ میکرومتر) و فراوانی (۲ تا ۴٪ گلبولهای سفید خون) آنها در خون از نوتروفیلها کمتر است و بیشتر در پاسخ به انگلها فعال میشوند. اما تعداد گرانولهای سیتوپلاسمی در این گرانولوسیتها بیشتر از نوتروفیلها است. تعداد زیادی آنزیم اسیدی در این گرانولها وجود دارد که پس از رنگآمیزی هماتوکسین-ائوزین زیر میکروسکوپ نوری، صورتی تا نارنجی دیده میشود.

اتصال آنتیژنهای عامل بیماریزا به آنتیبادی E در سطح ائوزرینوفیل با آزاد شدن مولکولهای شیمیایی از وزیکولهای ترشحی (به ویژه هیستامین) و از بین رفتن انگل همراه است. این گرانولوسیتها علاوه بر پاسخ به انگلها در ایجاد واکنشهای حساسیت (آلرژی) و التهاب مزمن در بدن نقش دارند. ائوزینوفیلها در جریان خون، مخاط لوله گوارش و مسیرهای تنفسی وجود دارد.
بازوفیل
بازوفیلها سومین دسته از سلولهای ایمنی دفاع غیراختصاصی بدن هستند. این سلولها علاوه بر مشارکت در دفاع غیراختصاصی (واکنش به پاتوژن، انگل و آلرژن) با ترشح آنزیم از لخته شدن خون جلوگیری میکنند. قطر این سلولهای کروی بین ۱۰ تا ۱۴ میکرومتر است و مثل سایر سلولهای ایمنی دفاع غیراختصاصی در مغز قرمز استخوان تشکیل میشود. ویژگی ظاهری که این سلولها را از سایر گرانولوسیتها جدا میکند، هسته لوبیایی شکل و گرانولهای بزرگ در سیتوپلاسم بازوفیلها است.
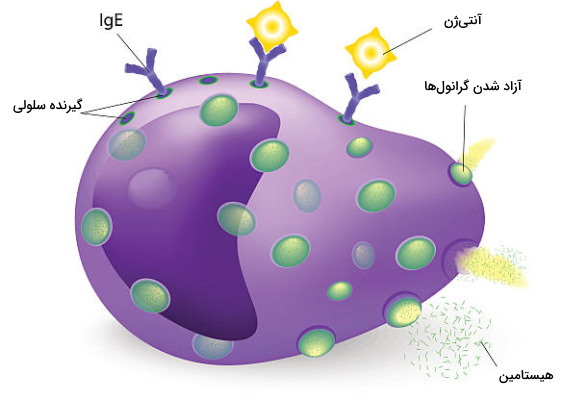
این سلولها درصد بسیار کمی از سلولهای ایمنی بدن را به خود اختصاص میدهند (حدود ۰٫۵٪) و طول عمر آنها بین ۶۰ تا ۷۰ ساعت است. در غشای پلاسمایی این سلولهای ایمنی مثل بازوفیلها آنتیبادی E وجود دارد. اتصال آنتیبادی به آنتیژنهای مختلف با آزاد شدن هیستامین، سروتونین و هپارین موجود در گرانولها، جذب گلبولهای سفید بیشتر به محل آسیب و شروع واکنشهای حساسیت همراه است.
مونوسیت
مونوسیتها سلولهای ایمنی آگرانولوسیت در دفاع غیراختصاصی بدن هستند. این سلولها در خون حضور دارند و پس از ورود به بافتهای مختلف به سلولهای ایمنی ماکروفاژ و سلولهای دندریتی تمایز مییابند. شکل هسته این سلولها بر اساس نوع بافتی که در آن حضور دارند، بیضی، لوبیایی و شبه اسب دیده میشود. در سیتوپلاسم مونوسیتها هیچ گرانولی وجود ندارد. قطر این سلولها بین ۱۵ تا ۲۰ میکرومتر، فراوانی آنها در خون ۲ تا ۸٪ کل سلولهای ایمنی و طول عمر آنها ۲۴ ساعت است.
ماکروفاژها و سلولهای دندریتی با فاگوسیتوز عامل بیماریزا و باقیماندههای سلولی در دفاع غیراختصاصی بدن نقش دارند. به علاوه در غشای سیتوپلاسمی این سلولها آنتیژنهای ویژهای به نام MHC II وجود دارد که به دفاع اختصاصی بدن برای شناسایی و پاسخ به آنتیژنهای مهاجم کمک میکند. به مونوسیتهایی که در فرایند فاگوسیتوز شرکت میکنند «فاگوسیت» (Phagocyte) و به مونوسیتهایی که در شناسایی آنتیژن به سلولهای ایمنی دفاع اختصاصی کمک میکنند، «سلولهای ارائهدهنده آنتیژن» (Antigen Presenting Cells | APCs) گفته میشود.
لنفوسیت های دفاع غیر اختصاصی
«سلولهای کشنده طبیعی» (Natural Killer Cells | NKs) تنها لنفوسیتهایی هستند که در ایمنی ذاتی یا غیراختصاصی بدن شرکت میکنند. این سلولها مثل سایر لنفوسیتها هسته بزرگ و سیتوپلاسم فاقد گرانول دارد. پروتئینهای CD3 در غشای این سلولها یکی از ویژگیهای تمایزی این لنفوسیت با لنفوسیتهای دفاع اختصاصی است. NKs به سلولهای T برای از بین بردن سلولهای آلوده به ویروس و سلولهای توموری کمک میکند.
گلبول های سفید دفاع اختصاصی
«لنفوسیتها» (Lymphocytes) سلولهای ایمنی اصلی در دفاع اختصاصی بدن هستند. این سلولها مثل سلولهای ایمنی دفاع غیراختصاصی در مغز استخوان و از تمایز سلولهای بنیادی لنفوئیدی تشکیل میشوند. اما مسیر تکامل آنها متفاوت است. لنفوسیتهای B، لنفوسیتهای T سلول ایمنی دفاع اختصاصی هستند که برای از بین بردن کامل عامل بیماریزا از بعضی سلولهای ایمنی دفاع غیراختصاصی کمک میگیرند.
لنفوسیتهای B پس از تکامل در مغز استخوان به جریان خون و سیستم لنفاوی (گرهها و اندامهای لنفاوی ازجمله طحال و لوزهها) منتقل میشوند. لنفوسیتهای T پس از تولید در مغز استخوان برای تکامل به غده تیموس و سپس اندامهای لنفاوی منتقل میشوند. قطر این سلولها بین ۱۲ تا ۱۵ میکرومتر است و حدود ۳۰٪ کل سلولهای ایمنی خون را به خود اختصاص میدهند. سیتوپلاسم این سلولها از هسته بسیار بزرگی تشکیل شده و برخلاف سلولهای گرانولوسیتهای دفاع غیراختصاصی فاقد گرانول است.
لنفوسیتها را میتوان بر اساس مولکولهای پروتئینی غشای پلاسمایی شناسایی کرد. گیرندههای لنفوسیت T یا TCRو گیرندههای لنفوسیت B یا BCR پروتئینهای اختصاصی غشای سلولهای T و سلولهای B هستند. این گیرنده ها از یک بخش ثابت و یک بخش متغیر تشکیل میشوند. بخش ثابت این گیرندهها برای اتصال غشای پلاسمایی و بخش متغیر آن به آنتیژن برای اتصال به آنتیژن طراحی شده است.
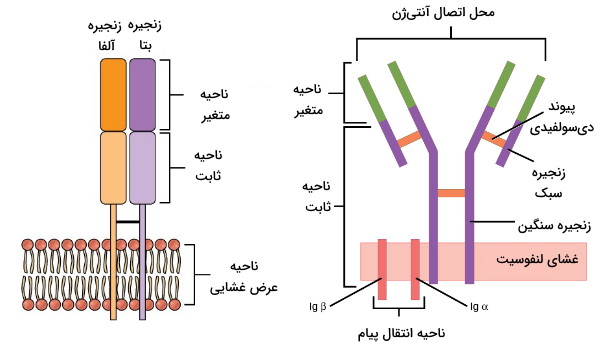
مکانیسم سلولهای ایمنی در پاسخ به عامل بیماریزا یک تفاوت دفاع اختصاصی و غیر اختصاصی بدن است. لنفوسیتها برخلاف سلولهای ایمنی دفاع غیراختصاصی بر اساس نوع آنتیژن پاسخ ایمنی ایجاد میکنند. طول عمر این سلولها نسبت به سلولهای ایمنی دفاع غیراختصاصی بیشتر و بین چند ماه تا چند سال است. لنفوسیتها با ترشح آنتیبادی (سلولهای B)، ترشح مولکولهای شیمیایی یا القای آپوپتوز (سلولهای T) عامل بیماریزا، سلولهای خودی آلوده به ویروس و سلولهای توموری را از بین میبرند.
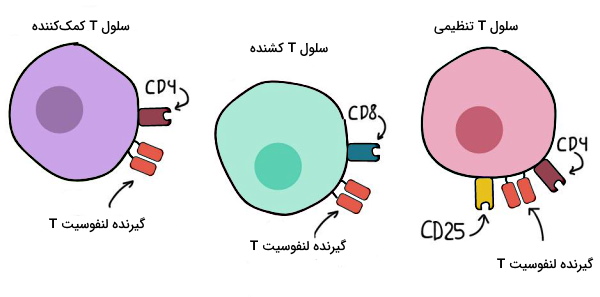
همچنین پروتئینهای غشای پلاسمایی (پروتئینهای دستهبندی تمایزی یا CD) به تقسیمبندی لنفوسیتهای T کمک میکنند. بر این اساس لنفوسیتهای T را میتوان به سه گروه سلول T کمککننده یا Th با پروتئین غشایی CD4، لنفوسیت T کشنده سلول یا CTL با پروتئین غشایی CD8 و سلولهای T تنظیمی یا $$T_{reg}$$ با پروتئین غشایی CD4 و CD35 تقسیم کرد.
تفاوت مکانیسم های دفاع اختصاصی و دفاع غیر اختصاصی چیست ؟
مهمترین تفاوت دفاع اختصاصی و غیر اختصاصی بدن در تخصصی بودن مکانیسیمهای دفاع اختصاصی و عمومی بودن مکانیسمهای دفاع غیراختصاصی است. سدهای ورودی (پوست و مولکولهای شیمیایی ضدمیکروب) و واکنشهای ایمنی عمومی (التهاب، پروتئینهای مکمل، تب و سلولهای غیراختصاصی) دو مکانیسم اصلی در دفاع غیراختصاصی برای مقابله با ورود و گسترش عوامل بیماریزا در بدن هستند. اما در دفاع اختصاصی سلولهای B پس از اتصال به آنتیژنهای ورودی آنتیبادی مکمل آن آنتیژن را ترشح (ایمنی هومورال یا مایعات بدن) و سلولهای T با ترشح سیتوکینهای اختصاصی مرگ برنامهریزی شده سلولها را فعال میکنند.
تفاوتهای این دو سیستم در جدول زیر خلاصه شده است.
| ویژگی | دفاع غیر اختصاصی | دفاع اختصاصی |
| فعال شدن | بخشهایی از سیستم دفاعی قبل از حضور عامل بیماریزا در بدن وجود دارد. | در پاسخ به عامل خارجی فعال میشود. |
| پاسخ تخصصی | ندارد. | دارد. |
| سرعت پاسخ | سریع | آهسته (یک یا دو هفته) |
| شدت پاسخ ایمنی | محدود و کم | زیاد |
| پایداری پاسخ | کوتاه مدت | زمان طولانیتر |
| خاطره | ندارد. | دارد. |
| تنوع | محدود | زیاد |
| مکانیسم | سدهای فیزیکی، شیمیایی و زیستی، پروتئینهای مکمل و گلبولهای سفید غیراختصاصی | ایمنی هومورال و سلولی |
| گلبولهای سفید | نوتروفیل، بازوفیل، ائوزینوفیل، ماکروفاژ،سلولهای کشنده طبیعی و سلولهای دندریتی | لنفوسیتهای B و T |
| زمان شکلگیری | بدو تولد | در طول زندگی فرد |
سد فیزیکی دفاع غیر اختصاصی
اولین خط دفاعی بدن در برابر تمام عوامل بیماریزا سدهای فیزیکی، شیمیایی و زیستی بدن است. پوست و بافت اپیتلیال در تمام بخشهای بدن که در تماس با محیط خارجی هستند ازجمله حفره بینی، مسیرهای تنفسی، لوله گوارش، مجاری ادراری و تولیدمثلی و گوش، سدهای فیزیکی و نفوذناپذیر بدن هستند. لایه شاخی پوست، نبود مویرگهای خونی، وجود غدد زیرمخاطی عرق و عدم توانایی لایه درم پوست در نگهداری رطوبت، محیطی فراهم میکند که به نفع رشد باکتریها نیست. به همین دلیل حتی اگر باکتریها از لایه شاخی عبور کنند در این لایه از بین خواهند رفت.
در لوله گوارش، نای و نایژه مخاط ترشح شده از سلولهای گابلت میکروبها و سایر عوامل بیماریزای ورودی به بدن را به دام میاندازند. به علاوه حرکت مژک سلولهای اپیتلیال این بخشهای بدن، میکروب به دام افتاده را همراه مخاط به بخشهای بینی یا معده منتقل میکند. مخاط ناحیه تنفسی و بخشهای ابتدایی لوله گوارش با فعالیتهای غیرارادی عطسه یا سرفه از بدن خارج میشود و شیره معده میکروب همراه مخاط بلعیده شده را از بین میبرد. آنزیم لیزوزیم موجود در براق یکی دیگر از مکانیسمهای دفاع غیراختصاصی بدن برای ورود میکروبها به بخشهای داخلی است. این پروتئاز با تجزیه آنزیمی پروتئینهای غشایی یا پروتئینهای تنظیمی از رشد باکتری جلوگیری میکند.
باکتریهای مفید بدن بخش سد زیستی دفاع غیراختصاصی را میسازند. این باکتریها در معده، روده و مجاری تولید مثلی با باکتریهای بیماریزا برای دریافت مواد غذایی و اکسیژن رقابت میکنند. بسیاری از باکتریهای ورودی به بدن در این رقابت حذف میشوند. در جدول زیر انواع سدهای دفاعی اولیه در اندامهای بدن خلاصه شده است.
| سد دفاع غیراختصاصی | مکانیسم دفاعی |
| پوست | عرق، لایه شاخی پوست، افزایش جریان خون و اسیدهای آلی |
| لوله گوارش | حرکات دودی، اسید معده، اسیدهای صفرا، آنزیمهای گوارشی، باکتریهای مفید و پروتئین دیفنسین |
| مسیرهای تنفسی و ریه | پروتئين دیفنسین، مخاط، حرکات مژکها و سورفاکتانت |
| حلق | مخاط، تغییر pH بزاق و لیزوزیم |
| چشمها | لیزوزوم اشک |
| سد خونی مغزی | محدود کردن انتشار و انتقال فعال مواد |
واکنش های عمومی دفاع غیر اختصاصی
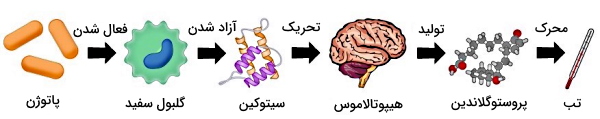
التهاب و سیستم پروتئینهای مکمل، دو واکنش عمومی دفاع غیراختصاصی بدن هستند که با مشارکت سلولهای ایمنی غیرتخصصی و مولکولهای شیمیایی ترشحی آنها، عوامل بیماریزا را از بین میبرند. مولکولهای شیمیایی ترشحشده در این مکانیسمها با اثر بر بخشهای مرکزی کنترل دمای بدن و ایجاد تب به حذف کامل عوامل بیماریزا کمک میکنند.
التهاب چیست ؟
اگر عوامل بیماریزا از اولین سد دفاع اختصاصی عبور کنند، التهاب سد دومی است که برای از بین بردن آنها فعال می شود. قرمز شدن، گرم شدن، ورم و ایجاد درد چهار ویژگی منطقه التهابی هستند. آسیب بافت به دلیل فشارهای فیزیکی (افتادن جسم سنگین روی پا) یا حمله عوامل بیماریزا منجر به آزاد شدن ترکیبات سلولی این بافتها (به ویژه لیپیدهای غشای پلاسمایی) و فعال شدن ماستسلهای بافت یا بازوفیلهای جریان خون میشود. فعال شدن این سلولها با آزاد شدن وزیکولهای سیتوپلاسمی حاوی سیتوکینها به ویژه هیستامین همراه است.
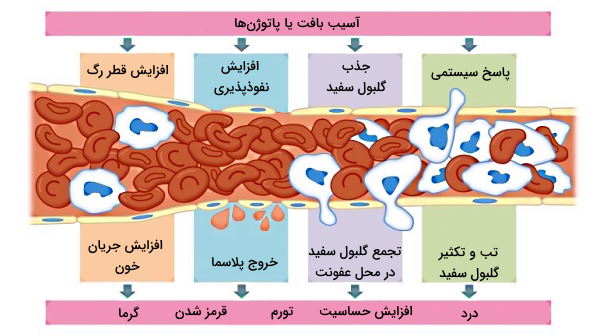
هیستامین با ایجاد تغییر در شکل سلولهای اندوتلیال دیواره، نفوذپذیر مویرگها به گلبولهای سفید را افزایش میدهد. همزمان سیتوکین ترشح شده از ماستسلها، گلبولهای بیشتری را از وجود عفونت با خبر میکند. نوتروفیلها اولین گلبولهای سفیدی هستند که در پاسخ به ماستسلها به محل عفونت میرسند. نوتروفیلها همراه ماکروفاژهای خروجی از خون یا مستقر در بافت با فرایند فاگوسیتوز عامل خارجی را از محل عفونت حذف میکنند.
تب چیست ؟
به افزایش غیرعادی دمای بدن تب گفته میشود. این وضعیت در پاسخ به پروستوگلاندینهای ترشح شده از سلول های ایمنی در زمان عفونت به وجود میآید. افزایش دمای بدن محیط با تغییر پروتئینهای ساختاری و آنزیمی، رشد میکروبها را متوقف یا کند میکند. به علاوه با فعال کردن پروتئینها شوک حرارتی متابولیسم سلولهای بدن و پاسخ ایمنی را افزایش میدهد. نکته مهم در مورد تب این است که افزایش دمای بدن تا زمانی که بر سلولهای خودی و مکانیسمهای آنها اثر نداشته باشد، مکانیسمی مفید است. اما اگر افزایش دما از آستانه تحمل سلولهای خودی بیشتر باشد، به این سلولها آسیب میزند.
فاگوسیتوز چیست ؟
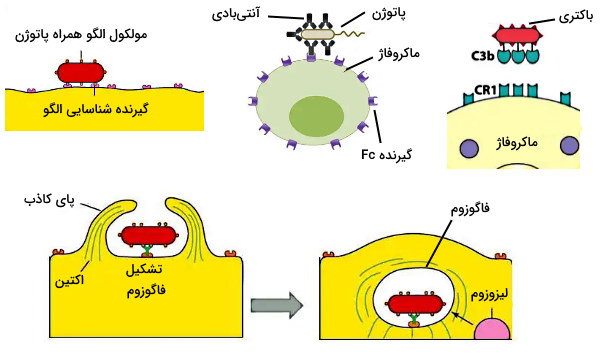
فاگوسیتوز یکی از مکانیسمهای سلولهای ایمنی در دفاع غیراختصاصی (نوتروفیل، ماکروفاژ و سلولهای دندریتی) برای از بین بردن عوامل بیماریزا است. در این فرایند چندمرحلهای میکرواورگانیسم بیماریزا یا باقیماندههای سلولهای آپوپتوز شده بهوسیله اندوسیتوز وارد سیتوپلاسم سلولهای ایمنی فاگوسیت شده و با مکانیسمهای متفاوت از بین میروند. فعال شدن و کموتاکسی فاگوسیت، شناسایی عامل مهاجم، بلع سلول و تشکیل فاگوزوم، از بین بردن میکروب و حذف یا اگزوسیتوز مراحل اصلی این فرایند هستند.
- فعال شدن و کموتاکسی فاگوسیت: اولین مرحله فاگوسیتوز حرکت گلبولهای سفید در پاسخ به سیتوکینهای ترشح شده در واکنش التهابی است که به آن کموتاکسی گفته میشود. همچنین سیتوکینها رونویسی و ترجمه ژنهای گیرندههای غشایی آنتیژن در این سلولها را افزایش میدهند.
- شناسایی عامل مهاجم: در این مرحله فاگوسیت با اتصال به آنتیژنهای سلول مهاجم این سلول را شناسایی میکند. اتصال آنتیژن-گیرنده در این مرحله با تغییر آرایش پروتئینهای اسکلت سلولی فاگوسیت و تشکیل پای کاذب همراه است. سه گیرنده اصلی در فاگوسیتها به شناسایی باکتریها و ویروسهای مختلف کمک میکنند.
- گیرندههای شناسایی الگو: این گیرندهها الگوی مولکولی مشخصی را در پاتوژن شناسایی میکنند. پپتیدوگلایکان و تایکوئیکاسید باکتری گرم مثبت، لیپوپلیساکارید باکتری گرم منفی، کربوهیدرات مانوز، پروتئین فلاژلین (تاژک باکتری)، پیلین یا DNA باکتری ازجمله مولکولهای الگو همراه پاتوژن (PAMPs) هستند.
- گیرندههای Fc: گیرندههای Fc یکی از پلهای ارتباطی دفاع غیراختصاصی و اختصاصی سیستم ایمنی هستند. این گیرندهها به بخش Fc آنتیبادیهای G و M متصل میشوند که به آنتیژن مهاجم متصل است. این فرایند که اوپسونیزاسیون نام دارد، فاگوسیتوز عامل مهاجم را افزایش میدهد.
- گیرندههای پروتئین مکمل: گیرنده پروتئینهای مکل یا CR1 به مجموعه پروتئینهای مکمل همراه با آنتیژن متصل میشود.
- بلع سلول و تشکیل فاگوزوم: پس از اتصال گیرنده-آنتیژن، پلیمریزاسیون و دپلیمریزاسیون رشتههای اکتین منجر به تشکیل پای کاذب و دربرگرفتن ذره مهاجم میشود. زمانیکه دو پای کاذب کامل بههم برسند و غشای پلاسمایی آنها با هم ادغام شود، وزیکول به نام فاگوزوم تشکیل خواهد شد که سلول مهاجم را وارد سیتوپلاسم فاگوسیت میکند.

- از بین بردن میکروب: در سیتوپلاسم فاکوسیت، فاگولیزوزوم از ادغام فاگوزوم تشکیل شده و اندامک لیزوزوم تشکیل میشود. باکتری بلعیده شده در فاگولیزوزوم با روشهای وابسته به اکسیژن یا بدون نیاز به اکسیژن تجزیه میشود.
- روشهای وابسته به اکسیژن: فاگوسیتهای فعال رادیکالهای اکسیژن و نیتروژنی تولید میکنند که خاصیت ضدمیکروبی دارد. در این سلولها با فعال شدن اکسیداز غشایی، یون سوپراکسید، رادیکالهای هیدروکسیل و هیدروژن پراکسید تولید میشود که با اتصال به غشا یا پروتئینهای تنظیمی باکتری، قارچ، انگلهای آغازی و کرمها، آپوپتوز عامل مهاجم را فعال میکنند.
- روشهای بدون نیاز به اکسیژن: سنتز آنزیمهای هیدرولازی تولید شده (لیزوزیم، کاتپسین G، الاستاز، کلاژناز و پروتئینهای افزایش نفوذپذیری غشای باکتری) در فاگوسیت فعال، افزایش مییابد. این آنزیمها بدون نیاز به باکتری با هیدرولیز مولکولهای زیستی سلول مهاجم، این سلولها را حذف میکنند.
- حذف یا اگزوسیتوز: آنتیژن عامل بیماریزا بهوسیله اگزوسیتوز کامل از نوتروفیلها خارج و وارد خون یا لنف میشود. اما در ماکروفاژها و سلولهای دندریتی که APC هستند، آنتیژنها پس از تغییر در غشای پلاسمایی قرار میگیرد تا به ایجاد دفاع اختصاصی کمک کند.
پردازش و ارائه آنتی ژن
پردازش آنتیژن فرایندی در سلولهای ارائهکننده آنتیژن (ماکروفاژها، سلولهای دندریتی و سلولهای B) است که آنتیژن را در واکنشهای آنزیمی به مولکولهای کوچکتری تجزیه میکند. سپس این مولکولهای کوچک همراه کمپلکس ویژه سازگاری بافت یا مولکولهای MHC به غشا سلول منتقل میشوند. سلولهای T تنها زمانی قادر به شناسایی آنتیژنها هستند که همراه MHC در غشای سلولهای ارائهکننده آنتیژن قرار دارد. MHC ها با انواع مختلف آنتیژنهای پپتیدی و کربوهیدراتی جفت میشوند و سلولهای T اتصال فیزیکی این دو مولکول را شناسایی میکنند. در ارائه آنتیژن دو گروه اصلی MHC I و MHC II شرکت میکنند که از رونویسی ژنهای متفاوت سنتز میشوند اما عملکرد مشابهی دارند.
- MHC I: همه ویروسها و برخی انگلها، قارچها و تعدادی کمی از باکتریهای بیماریزا در سیتوپلاسم سلولهای سالم رشد میکنند و آنتیژن آنها درونسلولی است. آنتیژن این پاتوژنها پس از پردازش در سیتوزول به شبکه اندوپلاسمی منتقل خواهد شد. در این اندامک آنتیژن با مولکولهای MHC I ترکیب و بهوسیله وزیکولهای انتقالی به غشای پلاسمایی سلول منتقل میشود. این مولکولها در تمام سلولهای هستهدار بدن انسان بیان میشوند تا از آلودگی ویروسی آنها جلوگیری کنند.
- MHC II: بسیاری از باکتریها، تعدادی از انگلها و قارچها خارج از سیتوپلاسم سلول رشد میکنند و آنتیژن آنها خارج سلولی است. آنتیژن این سلولها پس از فاگوسیتوز و تجزیه بخشهای سلولی، آنتیژن به دستگاه گلژی منتقل میشود. آنتیژن در این اندامک پس از اتصال به مولکول MHC II بهوسیله وزیکولهای انتقالی به غشای سلولی منتقل خواهد شد. این مولکولها تنها در سلولهای تخصصی ارائهدهنده آنتیژن بیان میشوند.
پروتئین های مکمل دفاع غیراختصاصی
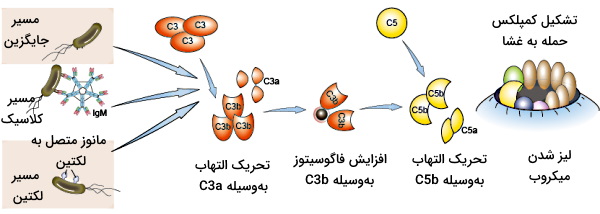
پروتئینهای مکمل بخش غیرسلولی دفاع غیراختصاصی بدن هستند. این پروتئینها از ۹ گروه پروتئین (C1-C9) تشکیل شده است که به آنتیژن متصل به باکتری یا آنتیبادی متصل میشوند و با سه مکانیسم متفاوت به حذف عامل مهاجم کمک میکنند. مسیر کلاسیک، مسیر لکتین-مانوز و مسیر جایگزین، سه مکانیسم پروتئینهای مکمل برای از بین بردن عوامل بیماریزا هستند که تفاوت آنها در اولین مولکولی است که پس از شناسایی آنتیژن به آن متصل میشود.
- مسیر کلاسیک: در این مسیر C1q که یک پروتئین محلول در پلاسما است به ناحیه Fc آنتیبادیهای متصل به میکروب، متصل میشود. برهمکنش این دو پروتئین با فعال شدن سرین پروتئازهای C1r و C1s همراه است. این پروتئازها، پروتئینهای مکمل دیگر را فعال میکنند.
- مسیر لکتین-مانوز: این مسیر بهوسیله پروتئین محلول در پلاسمایی به نام لکتین اتصالی به مانوز (MBL) شروع میشود. این پروتئین مانوز انتهایی در گلیکوپروتئینها و گلیکولیپیدهای غشای میکروبی را شناسایی میکند. پس از اتصال این پروتئین به آنتیژن دو آنزیم پروتئازی مثل آنزیمهای مسیر کلاسیک، پروتئینهای مکمل دیگر را فعال میکنند.
- مسیر جایگزین: در این روش پروتئین C3 آنتیژن مزاحم سطح باکتری (برای مثال لیپوپلیساکارید باکتری) را شناسایی و به آن متصل میشود.
پس از اتصال اولین پروتئین به آنتیژن آنزیم کانورتاز و سایز پروتئینهای مکمل فعال میشوند. در مسیر کلاسیک C4، C2، C3b، C5b و C6-C9 پروتئینهای مکملی هستند که به C1 متصل میشوند. در مسیر جایگزین C5B و C6-C9 به C3b متصل میشوند و در مسیر لکتین-مانوز C4، C2، C5B و C6-C9 به MBL متصل میشوند. پروتئينهای C5b-C9 با تشکیل مجموعه پروتئینی غشا، بین فسفولیپیدهای غشای پلاسمایی سلول مهاجم کانالی ایجاد میکنند که با خروج کردن سیتوپلاسم و محتویات آن منجر به لیز شدن سلول میشود.
ایمنی هومورال دفاع اختصاصی
تاخیر در ایجاد پاسخ ایمنی یک تفاوت دفاع اختصاصی و غیر اختصاصی است. این تاخیر به دلیل نیاز به فعال شدن و تقسیم لنفوسیتها ایجاد میشود. لنفوسیتهای B پس از برخورد با آنتیژن و در پاسخ به سیتوکینهای ترشح شده از Th فعال میشوند. این سلولها پس از فعال شدن با سرعت زیادی تقسیم میشوند و کلونی از سلولهای B کاملا مشابه تشکیل میدهند. در مرحله بعدی از تمایز سلولهای این کلونی پلاسموسیت یا سلولهای B خاطره ایجاد خواهد شد.
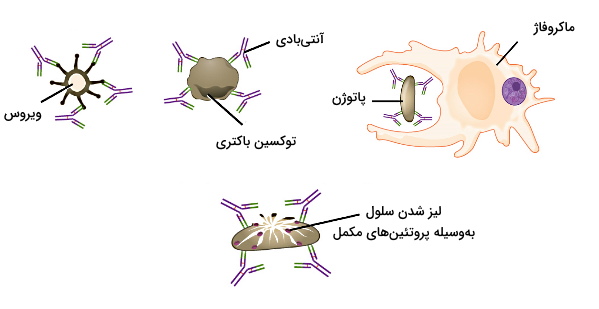
- پلاسموسیت: این سلولها وظیفه تولید آنتیبادی را بر عهده دارند. جهش و نوترکیبی ژنی در این سلولها به بدن کمک میکند برای هر آنتیژن یک آنتیبادی منحصر به فرد تولید کند. این مولکولها در خون، مایع میانبافتی، مخاط لوله گوارش و شیر مادر وجود دارد. آنتیبادیها با خنثیسازی، اوپسونیزاسیون و فعالسازی پروتئینهای مکمل دفاع غیراختصاصی در از بین بردن سلولهای مهاجم شرکت میکنند.
- سلول B خاطره: این سلولها در اولین برخورد با آنتیژن غیرفعال هستند. اما در برخورد دوم با همان میکروب، با شناسایی سریعتر آنتیژن سرعت ایجاد دفاع اختصاصی را افزایش میدهند.
ایمنی سلولی دفاع اختصاصی
در بخش قبلی توضیح دادیم که یکی از مکانیسمهای دفاع غیراختصاصی ایمنی ایجاد شده بهوسیله سلولها است. اما تخصصی بودن ایمنی سلولی لنفوسیتهای T یک تفاوت دفاع اختصاصی و غیر اختصاصی است. ایمنی سلولی دفاع اختصاصی برخلاف ایمنی هومورال، سلولهای خودی را از بین میبرد که بهوسیله عامل خارجی آلوده شدهاند. به علاوه این بخش از دفاع اختصاصی، اکتسابی یا تطبیقی با مهاجم شناختن آنتیژن سلولهای توموری و پیوندی در از بین بردن آنها نقش دارد.
گرههای لنفاوی مراکز اصلی پاسخ سلولی دفاع اختصاصی هستند. به همین دلیل اطراف تعداد این گرهها در مناطقی که بین بخشهای در ارتباط با محیط خارجی و بخشهای مرکزی ارتباط برقرار میکنند (گردن، کشاله ران و زیربغل) بیشتر است. لنفوسیت T بالغ در این گرهها آنتیژن پردازششده در APCs را پس از اتصال به TCR ویژه شناسایی میکند. پس از شناسایی آنتیژن تعداد سلولهای T به سرعت با تقسیم میتوزی افزایش مییابد. از آنجایی که سلولهای T ایجاد شده در این تقسیم کاملا شبیه سلول T تحریک شده اولیه هستند به این فرایند تشکیل کلونی سلولهای T گفته میود که برای ایجاد پاسخ ایمنی کافی ضروری است. فعالیت لنفوسیت T فعال شده بر اساس نوع آن متفاوت است.
لنفوسیت T کمک کننده
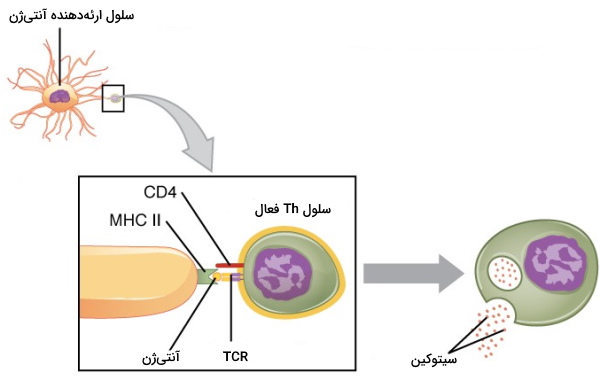
لنفوسیتهای T کمککننده آنتیژن متصل به مولکولهای MHC II در غشای APC را شناسایی میکنند و در ایجاد پاسخ ایمنی به پاتوژنهای خارج سلولی نقش دارند. در این برهمکنش TCR آنتیژن و CD4 مولکول MHC II را شناسایی میکند. دو رده Th در بدن انسان وجود دارد که پروتئینهای سطحی مشابهی دارند اما با ترشح سیتوکینهای متفاوت در دفاع اختصاصی بدن شرکت میکنند.
- Th1: این سلولها با ترشح سیتوکین ایمنیزایی و تکامل ماکروفاژها و سلولهای دندریتی را تنظیم میکند. فعال شدن ماکروفاژها با افزایش پاسخ التهابی دفاع غیراختصاصی همراه است.
- Th2: این لنفوسیتها با ترشح سیتوکین فعال شدن و تمایز سلولهای B به پلاسموسیت و سلول B خاطره را تحریک میکنند. پاسخ ایمنی سلولها B برای بسیاری از آنتیژنهای پپتیدی بدون ترشح سیتوکینها ایجاد نمیشود.
لنفوسیت T کشنده
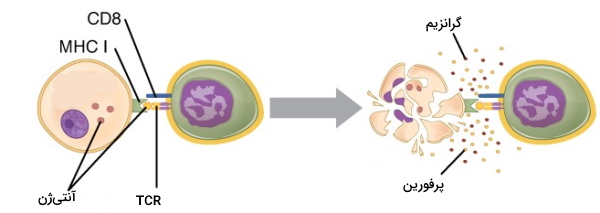
برای فعال شدن لنفوسیتهای T کشنده، گیرنده این سلولها با آنتیژن متصل به مولکول MHC I و پروتئین CD8 غشایی با مولکول MHC I برهمکنش میدهد. سلولهای CT پس از فعال شدن با ترشح پروتئینهای پرفورین یا گرانزیمها سلول خودی آلوده به ویروس یا سلول توموری را از بین میبرند. مونومرهای پرفورین در غشای سلول هدف کنار هم جمع میشوند و کانالی در غشا ایجاد میکنند. این کانال ورود گرانزیم به سیتوپلاسم را تسهیل میکند. به علاوه کانال ایجاد شده با ایجاد مسیر انتقال جدید یونها، تعادل اسمزی سلول را بههمریخته و لیز شدن سول را تحریک میکند. آنزیم گرانزیم پس از ورود به سیتوپلاسم مسیرهای آپوپتوزی مختلف ازجمله مسیر وابسته به کاسپاز را فعال میکند.
لنفوسیت T تنظیمی
ویژگی تمایزی لنفوسیتهای T تنظیمی یا مهاری با سلولهای Th و CT، وجود سه پروتئین CD4، CD25 و FOXP3 در غشای سیتوپلاسمی است. اگر این سلولها مرحله کلونی شدن لنفوسیتهای T در زمان عفونت را مهار نمیکردند، افزایش تعداد لنفوسیتها در نهایت منجر به ایجاد پاسخ ایمنی علیه سلولهای خودی و سالم بدن میشد. مکانیسم عمل این سلولها دقیق مشخص نیست. اما فعالیت آنها برای تنظیم ایمنی سلولی ضروری است. ویژگیها و عملکرد لنفوسیتهای T دفاع اختصاصی در جدول زیر خلاصه شده است.
| Tc | Th1 | Th2 | Treg | |
| سلول هدف | سلولهای توموری و آلوده به پاتوژن | ماکروفاژها | سلولهای B | سلولهای T |
| عملکرد | القای آپوپتوز و لیز شدن سلول | افزایش پاسخ ایمنی | فعال شدن سلول | مهار پاسخ ایمنی |
| نوع پاتوژن | درونسلولی | خارجسلولی | خارجسلولی | ---- |
| مولکول تمایزی | CD8 | CD4 | CD4 | CD4 و CD25 |
| MHC | نوع I | نوع II | نوع II | ---- |
| مولکول ترشحی | پرفورین، گرانزیم و لیگاند فاس | اینترفرون $$\gamma$$ و $$ TGF-beta$$ | انواع اینترلوکین بهویژه IL-4، IL-6 و IL-10 | IL-10 و $$ TGF-beta$$ |
تفاوت پاسخ اول و دوم در دفاع اختصاصی و غیر اختصاصی
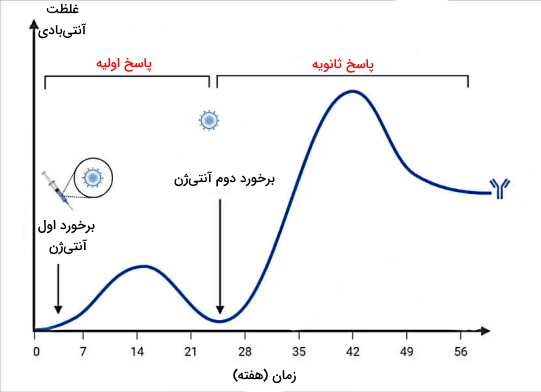
پاسخ اول به پاسخی گفته میشود که سیستم ایمنی بدن پس از اولین برخورد با عامل بیماریزا ایجاد میکند و پاسخ دوم زمانی ایجاد میشود که همان آنتیژن دوباره وارد بدن شود. یک تفاوت دفاع اختصاصی و غیر اختصاصی نوع ایجاد پاسخ ایمنی در برخورد اول و دوم با پاتوژن تکراری است. در بخشهای قبلی توضیح دادیم که دفاع غیراختصاصی تنها یک الگوی خاص آنتیژنی را شناسایی و پاسخ ایمنی ایجاد میکند. اما دفاع اختصاصی نه تنها تمایز الگوهای آنتیژنی بلکه نوع آنتیژن ورودی را شناسایی و برای آن پاسخ منحصر به فرد ایجاد میکند. در هر بار فعال شدن و تقسیم سلولهای ایمنی دفاع اختصاصی علاوه بر سلولهای عملکننده (پلاسموسیت، سلول T کمککننده و سلول T کشنده) سلولهای خاطرهای ایجاد میشوند که گیرنده آنها کملا شبیه سلولهای عملکننده است. با این تفاوت که در برخورد اول غیرفعال هستند. این سلولها برای ماهها تا سالها در سیستم لنفاوی بدن باقیمیمانند.
در برخورد دوم با همان آنتیژن دفاع غیراختصاصی بدن مثل همیشه پاسخی عمومی و سریع به عامل مهاجم میدهد. اما برهمکنش سلولهای B و T خاطره با آنتیژنی که از قبل شناسایی شده، سرعت و شدت پاسخ دفاع اختصاصی به بدن را افزایش میدهد. به همین دلیل ممکن است آنتیژن قبل از ایجاد بیماری یا کمترین علائم آن از بدن شما حذف شود. پاسخ ایمنی ثانویه ۳ تا ۵ (دروه کمون کمتر) اما در برخورد اول با آنتیژن ۷ تا ۱۰ روز پس از ورود آنتیژن به بدن ایجاد میشود (دوره کمون بیشتر). به علاوه چون سلولهای جدید فرصت بیشتری برای نوترکیبی و تمایز دارند، تمایل آنتیبادیهای تولید شده در پاسخ دوم به آنتیژن بیشتر از آنتیبادیهای پاسخ اول است. در نتیجه شدت دفاع اختصاصی افزایش مییابد. از این ویژگی دفاع اختصاصی در واکسیناسیون برای پیشگیری از ابتلا به بیماری بهره برده میشود.
جمع بندی
در این مطلب توضیح دادیم که دفاع اختصاصی و غیر اختصاصی دو بخش از سیستم ایمنی بدن هستند که با مشارکت هم از بدن در برابر عوامل بیماریزای مختلف محافظت میکنند. نوع گلبولهای سفید هر دفاع، پروتئینهای ترشح شده برای از بین بردن عامل بیماریزا، سرعت ایجاد پاسخ در برخورد اول و دوم با پاتوژن، شیوه شناسایی آنتیژن و پایداری پاسخ ایجاد شده تفاوت دفاع اختصاصی و غیر اختصاصی است.