ترمودینامیک چیست؟ – آموزش علم و قوانین به زبان ساده

ترمودینامیک موضوعی است که در فیزیک، شیمی، مهندسی و بسیاری از درسهای دانشگاهی مطالعه میشود، زیرا اثر قابلتوجهی بر ماده و انرژی دارد. در نگاه نخست، درک و یادگیری مفهوم ترمودینامیک غیرممکن به نظر میرسد. اما اگر وقت و زمان لازم برای درک مفاهیم پایه این شاخه از علم صرف شود، یادگیری آن دور از انتظار نخواهد بود. ترمودینامیک در ابتدا از سه قانون اصلی تشکیل شده بود، اما بعدها و با پیشرفت آن، قانون بنیادی دیگری نیز، به نام قانون صفرم ترمودینامیک، به آن اضافه شد. در این مطلب، ابتدا به پرسش ترمودینامیک چیست به زبان ساده پاسخ میدهیم. سپس در مورد قانونهای صفرم، اول، دوم و سوم ترمودینامیک و شاخههای مختلف آن صحبت میکنیم.
ترمودینامیک چیست ؟
ترمودینامیک شاخهای از فیزیک است که در مورد گرما، کار، دما و رابطه آنها با انرژی، تشعشع و ویژگیهای فیزیکی ماده مطالعه میکند. کلمه ترمودینامیک از دو بخش ترمو و دینامیک تشکیل شده است. ترمو به معنای گرما یا انرژی و دینامیک به معنای انتقال گرما یا انرژی است. بنابراین، در این شاخه از علم در مورد رابطه بین چگونگی انتقال گرما یا انرژی از نقطهای به نقطه دیگر صحبت میکنیم. ترمودینامیک موضوعی است که در فیزیک، شیمی و مهندسی مطالعه میشود.
دانشمندان سوالات زیادی در مورد مفاهیم اولیه انتقال گرما داشتند و پاسخ بسیاری از سوالات مطرح شده را نمیدانستند. به عنوان مثال، چگونگی گرم یا سرد شدن مواد و مفهوم دما را نمیتوانشتند به خوبی توضیح دهند. حتی در سالهای بسیار دور راه مناسبی برای اندازهگیری دما وجود نداشت. گالیله و نیوتن تلاش بسیاری برای یافتن راه مناسبی برای اندازهگیری دما کردند، اما موفق نبودند.
سرانجام، «گابریل فارنهایت» (Gabriel Fahrenheit) در قرن هجدهم میلادی توانست دما را اندازه بگیرد، اما توضیح مناسبی برای چرایی گرم یا سرد شدن مواد نیافت. دانشمندان زیادی، مانند «آنتونی لاوازیه» (Antonie Lavoisier) تلاش کردند تا چرایی این موضوع را توضیح دهند. او از نظریه کالری برای توضیح انتقال گرما یا حرارت استفاده کرد. بر طبق این نظریه، گرما به صورت اِتِر یا مایعی بیرنگ منتقل میشود.
لاوازیه بیان کرد که گرما یا حرارت از جسم با دمای بالاتر به جسم با دمای پایینتر منتقل میشود. گرچه لاوازیه این نظریه را قبول داشت، اما مفهوم آن اشتباه بود. در حقیقت، در قرن ۱۸ میلادی از اتر برای توضیح بسیاری از پدیدههای ناشناخته استفاده میشد. نظریههای اترِ زیادی وجود داشتند که با یکدیگر متناقض بودند. تعداد زیادی از مهندسان، شیمیدانها، فیزیکدانها و ریاضیدانها در سراسر جهان تلاش کردند تا فیزیک حاکم بر گرما و حرکت را بهدست آورند.
پس از توضیح ساده بالا و بعد از اینکه فهمیدیم ترمودینامیک چیست شاید این پرسش برایتان مطرح شود که این شاخه از فیزیک چه تفاوتی با مکانیک کلاسیک دارد. در ادامه، به این پرسش پاسخ میدهیم. ترمودینامیک یکی از شاخههای مهم رشته فیزیک است. برای موفقیت در این رشته باید با این بخش به خوبی آشنا باشید. بنابراین، با مراجعه به مجموعه آموزش ترمودینامیک درس، تمرین، حل مثال و تست فرادرس و تماشای فیلمهای آموزشی مرتبط میتوانید با خیالی راحت از یادگیری مفاهیم پایه و پیشرفته مطمئن شوید.
تفاوت مکانیک و ترمودینامیک چیست ؟
تا اینجا میدانیم ترمودینامیک چیست. دانستن تفاوت این شاخه از فیزیک با مکانیک، خالی از لطف نیست. در فیزیک مکانیک، تنها روی حرکت ذرات و اجسام، تحتتاثیر نیروها و گشتاورها، تمرکز میکنیم. در مقابل، ترمودینامیک در حالت کلی تنها روی حرکت سیستم تمرکز نمیکند. در واقع، ترمودینامیک تنها به حالت ماکروسکوپی داخلی جسم توجه میکند.
جدول زمانی ترمودینامیک چیست ؟
مخترعی انگلیسی به نام «توماس نیوکامن» (Thomas Newcomen) در سال ۱۷۱۲ میلادی موتور بخار بهبودیافته را اختراع کرد. در حدود ۷۶ سال بعد و در سال ۱۷۹۸ میلادی، فیزیکدانی به نام «کانت رامفورد» (Count Rumford) آزمایشهایی در مورد تبدیل کار به گرما انجام داد. در سال ۱۸۲۴ میلادی، کارنو مقالهای تحت عنوان، انعکاس نیرو محرکه آتش، چاپ کرد. در سالهای بین ۱۸۴۰ تا ۱۸۵۰ میلادی دانشمندانی مانند «مِیِر» (Mayer)، «ژول» (Joule) و «هلمهولتز» (Helmholtz) هر کدام جداگانه جداگانه به اصل پایستگی انرژی رسیدند. ده سال بعد، «کلازیوس» (Clausius) قانون دوم ترمودینامیک را فرمولبندی کرد.

اکنون میدانیم ترمودینامیک چیست و چه تفاوتی با مکانیک کلاسیک دارد. در ادامه، در مورد قانونهای ترمودینامیک صحبت میکنیم.
قوانین ترمودینامیک چیست ؟
پس از پاسخ به پرسش ترمودینامیک چیست، در مورد قوانین آن صحبت میکنیم. ترمودینامیک از چهار قانون تشکیل شده است:
- قانون صفرم ترمودینامیک
- قانون اول ترمودینامیک
- قانون دوم ترمودینامیک
- قانون سوم ترمودینامیک
قبل از صحبت در مورد قانونهای ترمودینامیک، ابتدا کمی در مورد سیستمها و فرایندهای ترمودینامیکی صحبت میکنیم.
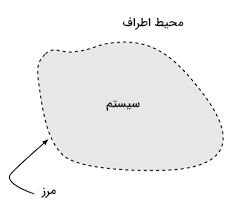
تعریف سیستم در ترمودینامیک چیست ؟
سیستم ترمودینامیکی قسمتی از جهان است که ویژگیهای ترمودینامیکی آن برای ما جالب به نظر میرسد. به بیان دیگر، سیستم ترمودینامیکی قسمتی از جهان است که برای مطالعه مستقیم خواص ترمودینامیکی انتخاب میشود. سیستمهای ترمودینامیکی به سه دسته تقسیم میشوند:
- سیستم باز
- سیستم بسته
- سیستم ایزوله یا منزوی
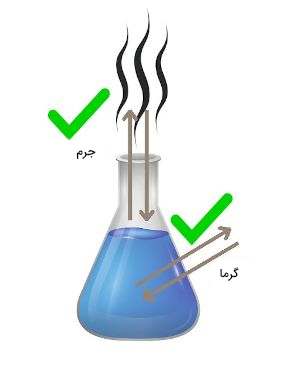
سیستم باز در ترمودینامیک چیست ؟
ظرف بدون درپوشی را در نظر بگیرید که با آب پر شده است. در سیستم باز، جرم یا در حالت کلی ماده میتواند به داخل یا خارج سیستم جریان داشته باشد. به عنوان مثال، در ظرف پر شده از آب و بدون درپوش، اکسیژن به راحتی میتواند به وارد سیستم یا از آن خارج شود. حالت مشابهی نیز برای انرژی، مانند انرژی گرمایی یا نورانی، برقرار است. در نتیجه، در سیستم ترمودینامیکی باز، ماده و انرژی میتوانند به سیستم وارد یا از آن خارج شوند.
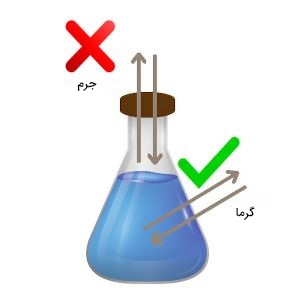
سیستم بسته در ترمودینامیک چیست ؟
در این حالت، سیستم مهروموم شده است. بنابراین، ماده یا جرم نمیتواند به سیستم وارد یا از آن خارج شود. به عنوان مثال، گاز اکسیژن در هوا وارد سیستم بسته ترمودینامیکی نخواهد شد. اما، انرژی گرمایی میتواند به سیستم بسته ترمودینامیکی وارد یا از آن خارج شود. از اینرو، سیستم بسته ترمودینامیکی در مقابل گرما ایزوله نیست.
سیستم ایزوله یا منزوی در ترمودینامیک چیست ؟
در این حالت، سیستم ترمودینامیکی به خوبی ایزوله شده است. در سیستم ایزوله همانند سیستم بسته، ماده نمیتواند به سیستم وارد یا از آن خارج شود. به عنوان مثال، اگر ظرف حاوی آب را به خوبی ایزوله کنیم، اکسیژن هوا نمیتواند به داخل آن نفوذ کند. علاوه بر ماده، در سیستمهای ایزوله ترمودینامیکی، گرما نیز نمیتواند به سیستم وارد یا از آن خارج شود.
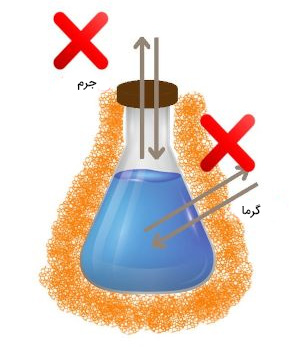
- نکته ۱: در سیستمهای ترمودینامیکی باز، ماده و انرژی میتوانند به سیستم وارد و از آن خارج شوند.
- نکته ۲: در سیستمهای ترمودینامیکی بسته، ماده نمیتواند به سیستم وارد یا از آن خارج شود. سیستمهای بسته در مقال عبور انرژی ایزوله نیستند.
- نکته ۳: در سیستمهای ترمودینامیکی ایزوله یا منزوی، انرژی و ماده نمیتوانند به سیستم وارد یا از آن خارج شوند.
۳ نکته بالا در جدول زیر به صورت خلاصه آمدهاند.
| نوع سیستم | جریان جرم | کار | گرما |
| سیستم ایزوله | × | × | × |
| سیستم باز | $$\checkmark$$ | $$\checkmark$$ | $$\checkmark$$ |
| سیستم بسته | × | $$\checkmark$$ | $$\checkmark$$ |
همانطور که در جدول بالا دیده میشود در سیستمهای باز و بسته، علاوه بر آنکه گرما میتوان به سیستم وارد یا از آن خارج شود، سیستم یا محیط اطراف به ترتیب میتوانند روی محیط اطراف یا سیستم کار انجام دهند. تا اینجا میدانیم ترمودینامیک چیست و سیستمهای ترمودینامیکی به چند دسته تقسیم میشوند. قبل از بیان قوانین ترمودینامیک، لازم است با فرایندهای ترمودینامیکی و دو مفهوم گرما و دما نیز آشنا شویم.
اکنون میدانیم تعریف سیستم در ترمودینامیک چیست و چند نوع سیستم داریم. در ادامه، در مورد فرایندهای ترمودینامیکی صحبت میکنیم.
فرایند در ترمودینامیک چیست ؟
سیستمی مشخص هنگامی تحت فرایند ترمودینامیکی قرار میگیرد که در آن مقداری تغییر انرژی وجود داشته باشد. این تغییر انرژی با تغییرات فشار، حجم و انرژی درونی همراه است. فرایندهای ترمودینامیکی به چهار دسته تقسیم میشوند. هر دسته ویژگیهای منحصر به خود را دارد:
- فرایند بیدرو یا آدیاباتیک: در این فرایند، هیچ گرمایی به سیستم وارد یا از آن خارج نمیشود. توجه به این نکته مهم است که در فرایند بیدرو، تبادل گرمایی به هنگام انبساط یا انقباض سیستم، برابر صفر خواهد بود. این فرایند میتواند برگشتپذیر یا برگشتناپذیر باشد. شرایط زیر برای رخ دادن این فرایند ضروری هستند:
- سیستم باید به طور کامل از محیط اطراف خود جدا شده باشد.
- فرایند باید سریع انجام شود تا زمان کافی برای انتقال گرما وجود نداشته باشد.
به عنوان مثال، تراکم گاز داخل سیلندر موتور به اندازهای سریع رخ میدهد که در مدت زمان تراکم، مقدار انرژی تولید شده داخل سیستم کمینه باشد.

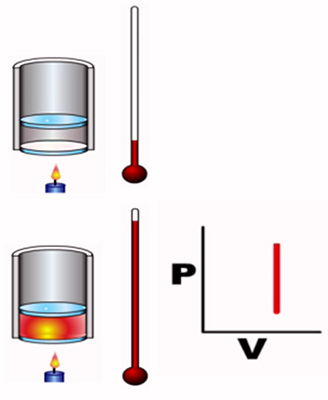
- فرایند همحجم: در این فرایند تغییر حجم سیستم و در نتیجه کار انجام شده برابر صفر خواهد بود. به فرایند همحجم، فرایند ایزومتریک یا حجم ثابت نیز گفته میشود. ثابت ماندن حجم به معنای برابر بودن حجم سیستم در آغاز و پایان فرایند است:
$$V _ f = V _ i (\triangle v = 0 \, d v = 0 )$$
از آنجا که کار انجام شده توسط سیستم در این فرایند برابر صفر است، تغییرات گرما برابر تغییرات انرژی درونی سیستم میشود.
- فرایند همفشار یا ایزوبار: فرایند همفشار، فرایندی ترمودینامیکی است که در فشار ثابت رخ میدهد. نام «ایزوبار» (Isobar) از کلمههای یونانی Iso به معنای مساوی و baros به معنای فشار گرفته شده است. فشار ثابت هنگامی بهدست میآید که حجم منبسط یا منقبض میشود. به این ترتیب، هر تغییر فشاری به دلیل انتقال گرما، خنثی خواهد شد. در فرایند همفشار، به هنگام انتقال گرما به سیستم، مقداری کار انجام میشود. نباید فراموش کنیم علاوه بر انجام کار، انرژی درونی سیستم نیز تغییر میکند. این بدان معنا است که هیچ کمیتی در قانون اول ترمودینامیک برابر صفر نمیشود.

- فرایند همدما: فرایند همدما، فرایندی ترمودینامیکی است که در دمای ثابت رخ میدهد. به بیان دیگر، دمای سیستم در فرایند همدما ثابت میماند. در واقع، انتقال گرما به سیستم یا خروج گرما از آن به اندازهای آهسته انجام میشود که تعادل گرمایی برقرار باشد. این فرایند میتواند هنگامی رخ دهد که سیستم با منبع گرمایی خارجی در تماس باشد. در این حالت برای برقرار تعادل، سیستم به آهستگی و با استفاده از تبادل حرارتی، دمای خود را با دمای منبع خارجی تطبیق میدهد.
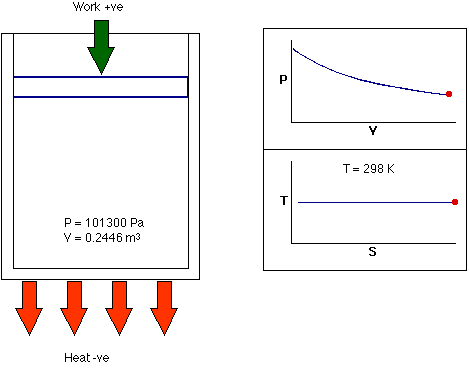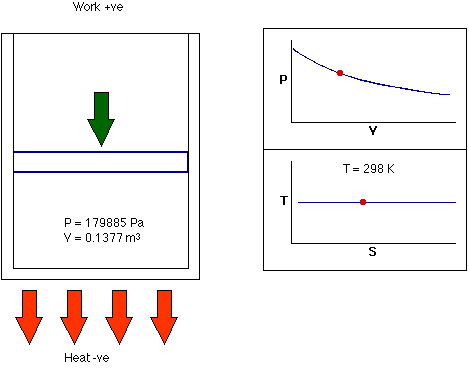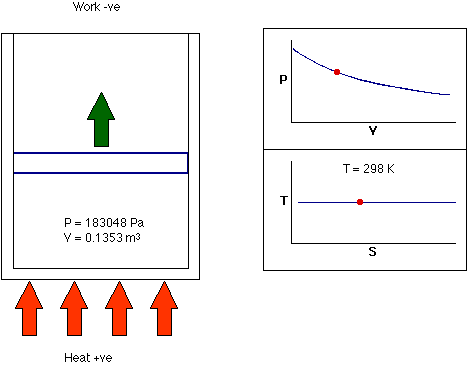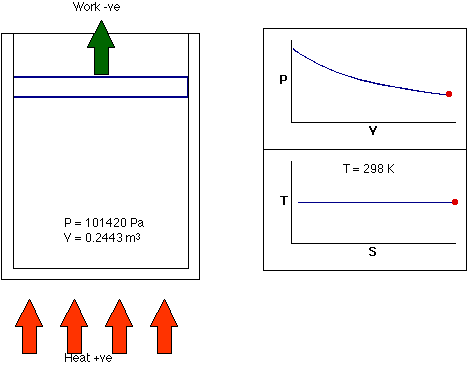
تا اینجا، میدانیم فرایندهای ترمودینامیکی و انواع آن چیست. در فرایندهای ترمودینامیکی گفته شده ممکن است یکی از کمیتهای ترمودینامیکی دما، فشار یا حجم ثابت باقی بماند و دو فرایند دیگر تغییر کنند. در هر یک از فرایندهای گفته شده، حالت نهایی سیستم با حالت اولیه آن متفاوت است. آیا ممکن است حالتهای نهایی و اولیه سیستم با یکدیگر برابر باشند؟ بله. این حالت در فرایند چرخهای رخ میدهد.
فرایند چرخه ای در ترمودینامیک چیست ؟
در فرایندهای چرخهای، حالت اولیه سیستم با حالت نهایی آن برابر است. همانطور که میدانیم تغییرات انرژی درونی سیستم همان تابع حالت است. بنابراین، در این حالت تغییرات انرژی درونی، یعنی $$\triangle U$$ برابر صفر خواهد بود.
مثال فرایند همدما
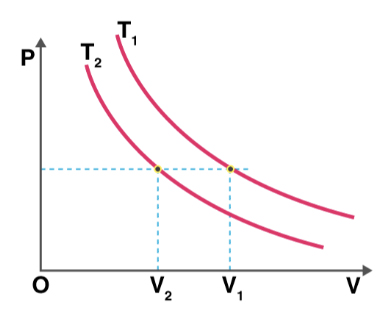
نمودار فشار برحسب حجم دو فرایند همدما در دو دمای متفاوت در تصویر زیر نشان داده شده است. دمای کدام فرایند بیشتر است؟
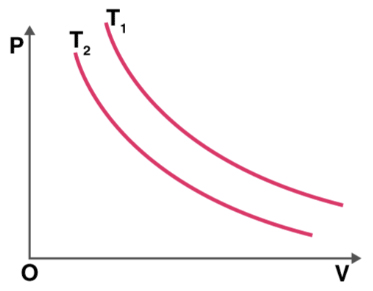
پاسخ
برای آنکه بدانیم دمای کدام فرایند بالاتر است، به صورت زیر عمل میکنیم:
- ابتدا، خطی افقی و موازی محور حجم رسم میکنیم.
- خط افقی، خط فشار ثابت را نشان میدهد.
- فرض کنید $$V _ 1$$ و $$V_ 2$$ به ترتیب حجمهای متعلق به دماهای $$T_ 2 $$ و $$T_1$$ هستند.
- میدانیم در فشار ثابت، با افزایش حجم گاز، دما نیز افزایش مییابد.
- با توجه به نمودار نشان داده شده در تصویر زیر میتوان گفت حجم $$V _ 1$$ بزرگتر از حجم $$V _ 2$$ است. بنابراین، دمای $$T_1$$ نیز بزرگتر از دمای $$T_2$$ خواهد بود.
- راه آسانتر دیگری نیری برای تعیین دما وجود دارد. نموداری که به مبدأ نزدیکتر است، دمای پایینتری خواهد داشت.
دما در ترمودینامیک چیست ؟
دانشمندان دما را به صورت حرکت مولکولهای ماده و انرژی جنبشی آنها تعریف کردهاند. اما سوالی که ممکن است مطرح شود آن است که این تعریف تا چه اندازه دقیق است. برای پاسخ به این پرسش باید بدانیم که انرژی، صورتهای مختلفی دارد. به عنوان مثال، نور، انرژی جنبشی خالص است، اما دما ندارد. تاکنون جایی ندیدهایم که دمای نور اندازه گرفته شود. شاید بگویید به هنگام خرید لامپ، روی برچسب آن دما نوشته شده است. باید به این نکته توجه داشته باشید که عدد نوشته شده دمای نور نیست، بلکه دمای فلزی است که نور را ساطع میکند. مفهوم دمای بدون وجود ماده هیچ معنای خارجی نخواهد داشت.
هر چیزی که جرم داشته باشد، ماده نامیده میشود. ماده از اتم تشکیل شده است و اتمها از ذرات ریزی به نام الکترون، پروتون و نوترون ساخته شدهاند. این ذرات، انرژی جنبشی دارند. گفتیم دما، حرکت مولکولها یا ذرات تشکیلدهنده ماده است. از آنجا که در مورد حرکت ذرات بسیار کوچک صحبت میکنیم، مفهومی به نام انرژی درونی مطرح میشود.
به انرژی درون ماده، انرژی درونی میگوییم. توجه به این نکته مهم است که انرژی درونی پروتونها و نوترونها، دما نیست بلکه جرم است. همچنین، انرژیِ پروتونها و نوترونها دما نیست، بلکه انرژی هستهای داخل اتم را تشکیل میدهند. انرژی بین مولکولها و اتمها نیز انرژی شیمیایی است. سرانجام به انرژی جنبشی مولکلها و اتمها میرسیم. به این انرژی، انرژی گرمایی گفته میشود.
به این نکته توجه داشته باشید که در این تعریف، حرکتی که به دلیل حرکت مولکولها ایجاد میشود را در نظر نگرفتهایم. مولکولهای داخل ماده به اطراف حرکت میکنند، از نقطهای به نقطه دیگر میروند و به دور خود میچرخند. تا زمانی که این حرکتها بر حرکت کلی ماده تاثیر نداشته باشند، همه چیز خوب به نظر میرسد. اما نکته گمراهکنندهای وجود دارد.
انرژی جنبشی دریاچهای نسبتا بزرگ همواره از انرژی جنبشی ما بیشتر است، اما دمای دریاچه و دمای بدن ما ممکن است با یکدیگر برابر باشند. حتی ممکن است دریاچه سردتر، اما انرژی جنبشی آن بیشتر باشد. بنابراین، دمای یکسان دو جسم به چه معنا است؟ اگر دو جسم را در کنار یکدیگر قرار دهیم، انرژی بین آنها مبادله میشود. اگر جسمی گرمتر از جسم دیگر باشد، انرژی از جسم گرمتر به جسم سردتر منتقل خواهد شد. بنابراین، جسم گرمتر، سردتر و جسم سردتر، گرمتر میشود.
اجازه دهید انتقال گرما از جسم گرمتر به سردتر را با مثالی ساده، بیشتر توضیح دهیم. پس از حمام، بدن خود را با حوله خشک میکنید. آب اضافه بدن توسط حوله جذب میشود. قبل از جذب آب بدن توسط حوله، مکانهایی روی حوله برای جذب آب وجود دارند. پس آز آنکه بیشتر آب بدن توسط حوله جذب شد، مکان جدیدی برای جذب آب بیشتر وجود ندارد و استفاده از آن حوله برای خشک کردن بدن فایدهای نخواهد داشت.
به این خاصیت، رطوبت گفته میشود. رطوبت میزان آب موجود در حوله را اندازه نمیگیرد، بلکه آب متوسط در هر توده پارچهای را اندازه میگیرد. به طور مشابه، دما مقدار کل انرژی جنبشی مولکولی را اندازه نمیگیرد، بلکه متوسط انرژی جنبشی بر واحد مولکول را اندازه میگیرد.
گرما در ترمودینامیک چیست ؟
در زمستان هوای سرد و در تابستان هوای گرم را به خوبی درک میکنیم. اما برای داشتن درک بهتری از مفهوم ترمودینامیک، باید گرما و دما را به صورت بنیادی و در مقیاس مولکولی تعریف کنیم. در مطالب بالا با مفهوم دما آشنا شدیم. به طور حتم عبارت دما را به طور متعدد در روزهای گرم تابستان یا سرد زمستان شنیدهاید. به هنگام صحبت در مورد گرمی یا سردی هوا یا هر جسم دلخواهی، به دمای آن توجه میکنیم. اما سوالی که ممکن است مطرح شود آن است که دما به صورت فیزیکی چه چیزی را اندازه میگیرد؟ دما مقدار انرژی گرمایی موجود برای انجام کار در سیستم را اندازه میگیرد.
گرما، مفهومی است که در بسیاری از موضوعهای فیزیک، مانند ترمودینامیک، مطرح میشود. توجه به این نکته مهم است که مفهوم گرما تنها محدود به فیزیک نیست، بلکه در بسیاری از رشتههای مهندسی مانند مهندسی مواد یا مهندسی هوافضا نیز از آن استفاده میشود. مواد مختلف از ذرات ریزی به نام مولکول تشکیل شدهاند. این مولکولها در تمام مواد، حتی مواد جامد، حرکت میکنند. دو مولکول نزدیک به هم را داخل ماده جامدی در نظر میگیریم. این دو مولکول توسط پیوند شیمیایی به یکدیگر متصل شدهاند.
پیوند شیمیایی بین مولکولهای را به خوبی میتوان توسط فنری کوچک شبیهسازی کرد. اگر دو ذره انرژی داشته باشند، به صورت طبیعی اطراف نقطه تعادل خود (نقطه تعادل فنر، نوسان میکنند. هرچه انرژی سیستم دو ذرهای بیشتر باشد، نوسان آنها شدیدتر خواهد بود.
ذرات تشکیلدهنده جسم داغ، انرژی جنبشی بیشتر و ذرات تشکیلدهنده جسم سرد، انرژی جنبشی کمتری دارند. به رابطه زیر دقت کنید:
$$\overline{KE} = \frac { 3 } { 2 } k T$$
همانطور که در رابطه فوق دیده میشود، انرژی جنبشی متوسط ذرات داخل سیستم متناسب با دمای سیستم است. با دانستن مفهوم دما، به راحتی میتوانیم گرما را تعریف کنیم. دو جسم A و B با دو دمای متفاوت را در نظر بگیرید.
فرض کنید دمای جسم A برابر ۲۰ درجه سانتیگراد و دمای جسم B برابر 80 درجه سانتیگراد باشد. دو جسم A و B همگن هستند و از ماده یکسانی ساخته و از بقیه جهان جدا (ایزوله) شدهاند. از آنجا که دمای سیستم A کمتر از دمای سیستم B است، ذرات تشکبلدهنده سیستم A کندتر از ذرات تشکیلدهنده سیستم B حرکت میکنند. دلیل این موضوع به انرژی جنبشی کمتر ذرات جسم A برمیگردد. در ادامه، دو جسم را در تماس با یکدیگر قرار میدهیم و به مرز تشکیل شده توسط آنها دقت میکنیم.
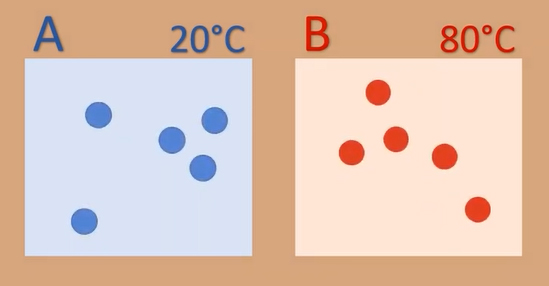
میدانیم ذرات در جسم جامد نوسان میکنند. بنابراین، هر ذره میتواند به ذره مجاور خود برخورد کند. برای راحتی کار، سه ذره با شمارههای ۱، ۲ و ۳ و به رنگ آبی را داخل جسم A و سه ذره با شمارههای ۴، ۵ و ۶ و به رنگ قرمز را داخل جسم B قرار میدهیم. در مرز تماس دو جسم با یکدیگر، ذرههای ۳ و ۴، در مجاورت یکدیگر قرار دارند. بنابراین، ذره ۴ با انرژی جنبشی بیشتر به ذره ۳ با انرژی جنبشی کمتر برخورد میکند.
به هنگام برخورد دو ذره با یکدیگر، مقداری از انرژی جنبشی ذره ۴ به ذره ۳ منتقل میشود. در این حالت میگوییم که ذره ۴ روی ذره ۳ کار انجام میدهد. انرژی جنبشی ذره ۳ پس از برخورد با ذره ۴ افزایش مییابد و از انرژی جنبشی ذره ۲ زیادتر میشود. در ادامه، ذره ۳ با ذره ۲ برخورد میکند. بنابراین، مقداری از انرژی جنبشی ذره ۳ به ذره ۲ منتقل میشود و انرژی جنبشی ذره ۲ افزایش مییابد.

اکنون به جسم B دقت میکنیم. انرژی جنبشی ذره ۴ در جسم B کمتر از انرژی جنبشی ذره ۵ است. پس از برخورد دو ذره ۴ و ۵ با یکدیگر، مقداری از انرژی جنبشی ذره ۵ به ذره ۴ منتقل میشود. بنابراین، انرژی جنبشی ذره ۴ افزایش مییابد. اما ذره ۵ مقدار از انرژی جنبشی خود را پس از برخورد با ذره ۴ از دست میدهد. حالتهای مشابهی برای ذرات ۱ و ۲ یا ۶ نیز رخ میدهد. اینگونه به نظر میرسد که مبادله انرژی جنبشی به تدریج گسترش مییابد. در طی این فرایند مقداری از انرژی جنبشی ذرات جسم B به ذرات جسم A منتقل میشود. در پایان، ذرات دو جسم، انرژی جنبشی یکسانی خواهند داشت.
به بیان دیگر، دمای دو جسم یکسان است. دو جسم A و B در تعادل گرمایی با یکدیگر قرار دارند. به بیان علمیتر، ذرات جسم گرمتر روی ذرات جسم سردتر، کار انجام دادهاند. انرژی از جسم B به جسم A منتقل شده است. به این انتقال انرژی، گرما میگوییم و برحسب ژول بیان میشود. به بیان دقیقتر، گرما برابر کار انجام شده توسط ذرات جسم گرمتر بر روی ذرات جسم سردتر است.
گرما، انتقال غیرمکانیکی انرژی است.
به عبارت غیرمکانیکی در تعریف گرما دقت کنید. آیا همواره باید از این عبارت در تعریف گرما استفاده کنیم؟ خیر. در حقیقت، گرما را میتوان به صورت فرایندی مکانیکی نیز نگاه کرد. در نگاه ماکروسکوپیک، هیچ برهمکنشی بین ذرات تکی نمیبینیم. گرما را به صورت فرایندی تک درک میکنیم. به بیان دقیقتر، گرما را میتوان به صورت انتقال انرژی از جسمی به جسم دیگر بدون هیچ کنش یا عمل مکانیکی تعریف کرد. به همین دلیل در تعریف گرما از عبارت غیرمکانیکی استفاده میشود. همچنین، گرما را میتوان به صورت انتقال انرژی درونی بین دو سیستم تعریف کرد.
تا اینجا، میدانیم تعریف گرما در ترمودینامیک چیست و با تعریف گرما و دما آشنا شدیم. در ادامه، در مورد قوانین ترمودینامیک صحبت میکنیم.
قانون صفرم ترمودینامیک چیست ؟
این قانون، در مورد تعادل گرمایی صحبت میکند. تعادل گرمایی بین دو سیستم هنگامی رخ میدهد که هیچ هدایت گرمایی بین آنها رخ ندهد. بر طبق این قانون، اگر دو سیستم به نامهای سیستمهای A و B با سیستم سومی به نام C در تعادل گرمایی باشند، دو سیستم A و B نیز با یکدیگر در تعادل گرمایی هستند. این جمله در نگاه نخست بسیار واضح به نظر میرسد، اما مفهوم بسیار مهمی در آن نهفته است. به بیان دیگر، اگر دمای دو جسم یکسان باشد، هیچ هدایت گرمایی بین آنها پس از تماس با یکدیگر اتفاق رخ نمیدهد. این جمله به ما میگوید که دما نشانهای از تعادل گرمایی است. دو جسم با دمای یکسان، در تعادل گرمایی با یکدیگر قرار دارند.
قانون اول ترمودینامیک چیست ؟
قبل از آنکه در مورد قانون اول ترمودینامیک صحبت کنیم، شکل ریاضی این قانون را مینویسیم.
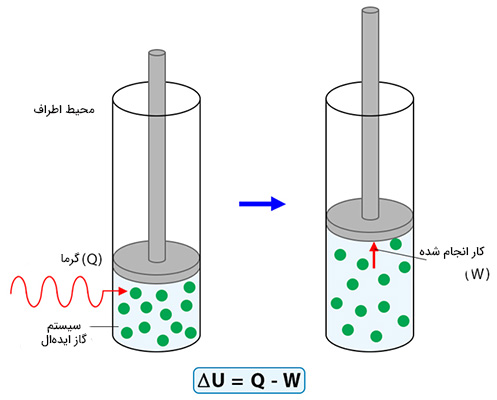
$$\triangle U = Q - W$$
این قانون به شکل $$\triangle U = Q + W$$ نیز نوشته میشود. شاید از خود بپرسید چرا قانون اول ترمودینامیک به این دو شکل نوشته میشود. برای رسیدن به پاسخ این پرسش، این قسمت را تا انتها مطالعه کنید.
در بیشتر موارد قانون اول ترمودینامیک را شکل دیگری از قانون پایستگی انرژی میدانند. بر طبق اصل پایستگی انرژی، انرژی نه به وجود میآید و نه از بین میرود، بلکه از شکلی به شکل دیگر تغییر میکند. اما این تعریف چه ارتباطی با قانون اول ترمودینامیک دارد؟ برای پاسخ به این پرسش ابتدا باید با هر یک از کمیتهای نوشته شده در معادله $$\triangle U - Q - W$$ آشنا شویم. در مطالب بالا با تعریف سیستم آشنا شدیم.
بنابراین، ابتدا باید سیستم را برای رسیدن به پاسخ پرسش پرسیده شده انتخاب کنیم. سیستم موردنظر را به شکل گازی داخل جعبه انتخاب میکنیم. بنابراین، جعبه از تعداد زیادی مولکولهای کوچک گاز تشکیل شده است. بنابراین، عبارت $$\triangle U$$ به تغییراتِ انرژی درونی سیستم اشاره دارد. گرچه این سیستم از تعداد زیادی ذرات کوچک تشکیل شده است، انرژی درونی را میتوان به صورت اندازهگیری حالت سیستم در نظر گرفت. موقعیت و سرعت هر ذره را نمیتوانیم برحسب زمان اندازه بگیریم. تنها با دانستن انرژی درونی گاز میتوانیم آن را در حالت کلی بررسی کنیم.
انرژی درونی مقدار انرژی موجود در سیستم را اندازه میگیرد یا مقدار انرژی لازم برای ساختن سیستم از ابتدا را به ما میدهد. به عنوان مثال، چه مقدار انرژی برای کنار هم قرار دادن مولکولهای گاز داخل جعبه مورد نیاز است. در قانون اول ترمودینامیک به تغییرات انرژی درونی سیستم ترمودینامیکی نگاه میکنیم. چگونه انرژی موجود در گاز داخل جعبه برحسب زمان افزایش یا کاهش مییابد؟ برای پاسخ به این پرسش باید به عبارت سمت راست معادله $$\triangle U = Q - W$$ نگاه کنیم. Q، بیانگر گرما است. در مطالب بالا گفتیم مفهوم گرما در ترمودینامیک چیست. هنگامی که گاز را گرم میکنیم، انرژی درونی آن افزایش مییابد.
به عنوان مثال، اگر شعلهای کوچک در نزدیکی جعبه قرار دهیم، انرژی به سیستم منتقل خواهد شد. به بیان دیگر، به جعبه گرما منتقل میشود، زیرا هیچ نیروی بزرگ مقیاسی بر جعبه اثر نمیگذارد تا به آن انرژی منتقل کند. بنابراین، دو نکته بسیار مهم را باید در مورد گرما در ترمودینامیک به خاطر بسپاریم:
- گرماِ انتقال انرژی است.
- گرما، انتقال انرژی از یا به سیستم موردنظر ما بدون وجود نیروهای ماکروسکوپی یا بزرگمقیاس است.
برای درک بهتر این موضوع، مثالی در مورد انتقال انرژی به سیستم با استفاده از نیروهای بزرگمقیاس میزنیم. سیستم انتخاب شده، جعبهای متشکل از مولکولهای بسیار کوچک گاز است. فرض کنید به جای یکی از دیوارهای جعبه، پیستونی قرار داده شده است. مولکولهای گاز به هنگام حرکت به اطراف، به پیستون نیز برخورد و به آن نیرو وارد میکنند. به همین دلیل پیستون به سمت خارج جعبه حرکت میکند.
در این حالت، مولکولهای گاز با پیستون در مقیاس کوچک برهمکنش میکنند. این برهمکنش در مقیاس کوچک سبب ایجاد نیرو در مقیاس بزرگ میشود که به راحتی قابل اندازهگیری است. این نیرو، پیستون را به سمت خارج حرکت میدهد. این انتقال انرژی، انتقال انرژی از مولکولهای گاز به پیستون، شکلی از گرما نیست، زیرا نیروی ماکروسکوپی به هنگام انتقال انرژی وجود دارد. به این شکل از انتقال انرژی، کار گفته میشود. انرژی منتقل شده برابر کار انجام شده توسط گاز بر روی پیستون است.
این شکل از انتقال انرژی همان عبارت دوم در معادله $$\triangle U = Q - W$$، یعنی W است. بنابراین، W به صورت کار انجام شده توسط سیستم ما بر روی محیط اطرافش تعریف میشود. از اینرو، معادله $$\triangle U = Q - W$$ را به صورت زیر میخوانیم:
تغییرات انرژی درونی سیستم برابر تفاضل مقدار انرژی کسب شده توسط سیستم به شکل گرما و انرژی از دست داده به شکل کار انجام شده بر روی محیط اطراف آن است.
عبارت بالا، شکل دیگری از قانون پایستگی انرژی است. توجه به این نکته مهم است که نمیتوانیم بگوییم گرما به تنهایی به دلیل مثبت بودن میتواند به سیستم انرژی دهد یا کار به تنهایی میتواند انرژی از سیستم بگیرد. مقدار Q ممکن است مثبت یا منفی باشد. هنگامی که محیط اطراف سبب گرم شدن سیستم شود، Q مثبت و هنگامی که سیستم سبب گرم شدن محیط اطراف خود شود، Q منفی خواهد بود. به طور مشابه، اگر محیط اطراف سیستم روی آن کار انجام دهد، W منفی است. فرض کنید معادله قانون اول ترمودینامیک به صورت زیر نوشته میشود:
$$\triangle U = Q - W$$
در این رابطه، علامت Q مثبت و علامت W منفی است. این بدان معنا است که Q انرژی منتقل شده به سیستم به دلیل گرما و W انرژی خارج شده از سیستم به دلیل کار انجام شده توسط سیستم روی محیط اطرافش، است. برای Q و W دو حالت وجود دارد:
- به سیستم گرما داده میشود و سیستم روی محیط اطرافش کار انجام میدهد. در این حالت، Q مثبت و W منفی است.
- از سیستم گرما گرفته میشود و محیط اطراف سیستم روی آن کار انجام میدهد. در این حالت، Q منفی و W مثبت است.
اگر W به صورت کار انجام شده روی سیستم تعریف شود، معادله قانون اول ترمودینامیک به صورت زیر نوشته خواهد شد:
$$\triangle U = Q + W$$
اینکه کدام معادله را انتخاب کنیم از اهمیت چندانی برخوردار نیست. تنها نکته مهم آن است که به تعریف مثبت و منفی بودن انرژی پایبند باشیم. نکته بسیار مهم در مورد قانون اول ترمودینامیک آن است که از دو رابطه $$\triangle U = Q - W$$ و $$\triangle U = Q + W$$ تنها هنگامی میتوانیم استفاده کنیم که هیچ مادهای به سیستم انتخاب شده وارد یا از آن خارج نشود. به بیان دیگر، در حالتی که سیستم انتخاب شده جعبهای متشکل از مولکولهای گاز است، هیچ مولکول گازی از سیستم خارج یا به آن وارد نمیشود. زیرا در این صورت ممکن است انرژی توسط ذرههای وارد یا خارج شده به سیستم منتقل یا از آن خارج شود. شاید از خود بپرسید قانون اول ترمودینامیک با چه معادلهای نشان داده میشود. این قانون در بیشتر موارد با معادله $$\triangle U = Q - W$$ نشان داده میشود.
تا اینجا میدانیم قانون اول ترمودینامیک چیست و چگونه تعریف میشود. در ادامه، برای آشنایی بیشتر با این قانون، آزمایش سادهای را انجام میدهیم. به این نکته توجه داشته باشید که برای انجام این آزمایش در منزل از افراد باتجربه کمک بگیرید.
آزمایش قانون اول ترمودینامیک
در مطالب بالا گفتیم قانون اول ترمودینامیک صورت دیگری از اصل پایستگی انرژی است. بر طبق این اصل، انرژی نه به وجود میآید و نه از بین میرود، بلکه از شکلی به شکل دیگر تغییر میکند. در این بخش، به منظور آشنایی بهتر با قانون اول ترمودینامیک، آزمابشی را با یکدیگر انجام میدهیم.
وسایل موردنیاز برای انجام آزمایش:
- آب به میزان کافی
- چایساز
- سطل با اندازه دلخواه
- بطری آب معدنی
- بادکنک
ابتدا، بطری آب معدنی با اندازه متوسط را برمیداریم و درپوش آن را خارج میکنیم. سپس، بادکنکی را به جای درپوش روی آن قرار میدهیم و بطری را داخل سطل میگذاریم. در ادامه، مقداری آب داخل کتری یا چایساز میریزیم و اجازه میدهیم تا به جوش آید. آبِ جوش را داخل سطل و اطراف بطری آب معدنی میریزیم. برای آنکه بطری از جای خود تکان نخورد باید آن را با دست نگه داریم. پس از ریختن آب جوش تا بالای سطل و نزدیکی درپوش بطری، با صحنه عجیبی روبرو میشویم. بادکنک، شروع به باد شدن میکند.

این آزمایش را برای بار دوم تکرار و اصلاح میکنیم. اینبار بطری آب معدنی را با استفاده از نخهای پلاستیکی و به صورت نشان داده شده در تصویر زیر محکم نگه میداریم. در ادامه، آب جوش را داخل سطل میریزیم تا جایی که نیمی از سطل پر شود و مشابه حالت قبل، بادکنک شروع به باد شدن میکند.

این آزمایش به صورت شماتیک در تصویر زیر نشان داده شده است. دمای بطری را با $$T_1$$ و دمای آب جوش را با $$T_2$$ نشان میدهیم. سیستم مورد نظر را بطری و آب جوش را محیط اطراف آن در نظر میگیریم. از آنجا که دمای آب جوش از دمای داخل بطری بیشتر است، داریم:
$$T_ 1 >\; T _ 2$$
از اینرو گرما از آب جوش به بطری منتقل میشود. در مطالب بالا گفتیم هنگامی که گرما به سیستم وارد میشود، Q مثبت خواهد بود. پس از گذشت مدت زمان مشخصی بطری روی محیط اطراف خود کار انجام میدهد و بادکنک باد میشود. در نتیجه، علامت W منفی است. شاید از خود بپرسید چرا بادکنک با میشود. هنگامی که آب جوش، داخل سطل ریخته میشود، گرما از محیط اطراف (آب جوش) به سیستم (هوای داخل بطری و بادکنک) منتقل میشود. در نتیجه، تغییرات انرژی درونی سیستم مثبت خواهد بود.
نتیجه آزمایش اول
برای انجام هر آزمایش ترمودینامیکی ابتدا باید سیستم موردنظر خود را انتخاب کنیم. در این آزمایش ظرف حاوی آب جوش و بطری به همراه بادکنک داریم. هوای داخل بطری و بادکنک را به عنوان سیستم و آب جوش را به عنوان محیط اطراف سیستم انتخاب کردیم. دمای محیط اطراف از دمای سیستم بیشتر است. بنابراین، گرما از محیط به سیستم منتقل میشود. همچنین، سیستم روی محیط اطرافش کار انجام میدهد.
آزمایش دوم
آزمایش دیگری را برای درک بهتر قانون اول ترمودینامیک با یکدیگر انجام میدهیم. وسایل موردنیاز برای انجام این آزمایش عبارت هستند از:
- آب به مقدار کافی
- سطل با اندازه دلخواه
- هیتر یا چراغ الکلی
- قوطی خالی نوشابه از جنس آلومینیوم
- نگهدارنده
قوطی خالی نوشابه را به مدت ۵ دقیقه، به صورت نشان داده شده در تصویر زیر و با استفاده از نگهدارنده روی چراغ الکلی یا هیتر نگه میداریم.

پس از آنکه قوطی به اندازه کافی گرم شد، بلافاصله آن را به صورت برعکس داخل آب ولرم فرو میبریم و اتفاق جالبی را مشاهده میکنیم. قوطی با صدای بلندی شبیه انفجار، مچاله میشود.

به نظر شما سیستم در این آزمایش چگونه انتخاب شده است؟ هوای داخل قوطی آلومینیومی و خود قوطی به عنوان سیستم انتخاب شدهاند. در این آزمایش، برخلاف آزمایش قبل، دمای محیط اطراف کمتر از دمای سیستم موردنظر است. از اینرو، گرما از سیستم خارج و وارد محیط اطراف سیستم میشود. بنابراین، Q منفی است. همچنین، کار محیط اطراف روی سیستم کار انجام میدهد. در نتیجه، W مثبت خواهد بود.
تا اینجا میدانیم قانون دوم ترمودینامیک چیست و چگونه بیان میشود. در ادامه، برای آشنایی بیشتر با این قانون، آزمایش سادهای را انجام میدهیم. به این نکته توجه داشته باشید که برای انجام این آزمایش در منزل از افراد باتجربه کمک بگیرید.
قانون دوم ترمودینامیک چیست ؟
قانون دوم ترمودینامیک، قانون بنیادی طبیعت است. بدون اغراق، این قانون یکی از ارزشمندترین کشفهای انجام شده توسط انسان است. درک این قانون برای بیشتر دانشآموزان، دانشجویان و مهندسان بسیار سخت است. دلیل این موضوع آن است که مفاهیم پیچیده زیادی مانند آنتالپی، آنتروپی یا انرژی آزاد گیبس در این قانون استفاده شده است. راههای زیادی برای بیان قانون دوم ترمودینامیک وجود دارند، اما نکته مهم آن است که بیشتر افراد هیچ کاربردی از این قانون در زندگی روزمره در ذهن خود ندارند. در این بخش، سعی شده است که این قانون به زبان ساده و با کمترین استفاده از معادلات ریاضی توضیح داده شود.
یکی از اصلیترین استفادههای قانون دوم ترمودینامیک آن است که تعیین کنیم آیا فرایندی خودبهخودی است یا خیر. برای درک بهتر این موضوع، چند مثال میزنیم. دو گاز را در نظر بگیرید که با یکدیگر مخلوط میشوند. هوا از بادکنک خارج یا چای داغ پس از گذشت مدت زمان مشخصی سرد میشود و جرم از ارتفاع مشخصی سقوط میکند. در هر یک از مثالهای ذکر شده، تغییر از حالت یک به حالت دو به صورت خودبهخودی رخ میدهد. مخلوط شدن دو گاز با یکدیگر را در نظر بگیرید. در حالت یک، دیوارهای بین دو گاز قرار دارد. پس از برداشتن دیواره، دو گاز به صورت خودبهخودی با یکدیگر مخلوط میشوند.

در مثال دوم، ابتدا بادکنکی باد شده داریم. اگر نخ بسته شده به انتهای بادکنک باز شود، باد آن به طور کامل خالی میشود. تغییر از حالت یک (بادکنک پرباد) به حالت دو (خالی شدن باد بادکنک)، فرایندی خودبهخودی است.

در مثال سوم، جرمی به طناب یا فنر بسته شده است. در صورتی که جرم بسته شده رها شود، به صورت خودبهخودی به سمت زمین حرکت میکند. در مثال چهار نیز اگر چای یا قهوه داغ را در محیط اتاق قرار دهیم، پس از مدتی خواهیم دید که گرمای زیادی از دست دادهاند و دمای آنها به طور محسوسی کاهش یافته است. همانطور که در این چهار مثال مشاهده میشود، تمام فرایندها به صورت خودبهخودی و بدون کمک خارجی انجام شدهاند. اما سوالی که ممکن است مطرح شود آن است که حالت ۲ به یک در هر یک از این فرایندها چگونه است. آیا آنها نیز به طور خودبهخودی و بدون کمک خارجی انجام میشوند؟
- آیا گازهای مخلوط شده به طور خودبهخودی و بدون کمک خارجی از یکدیگر جدا میشوند؟
- آیا بادکنک به طور خودبهخودی و بدون کمک خارجی باد میشود؟
- آیا جرم رها شده به طور خودبهخودی و بدون کمک خارجی به ارتفاع قبلی خود برمیگردد؟
- آیا چای یا قهوه سرد شده به طور خودبهخودی و بدون کمک خارجی دوباره گرم میشود؟
براساس تجربه روزمره میدانیم هیچ یک از حالتهای گفته شده در بالا (حالت ۲ به یک) به صورت خودبهخودی و بدون کمک خارجی رخ نمیدهند. بنابراین فرایندهای دو به یک خودبهخود نیستند. گرچه بر طبق قانون پایستگی انرژی یا قانون اول ترمودینامیک، حتی فرایندهای دو به یک نیز ممکن هستند. زیرا انرژی در هر حالت یکسان است. بنابراین، سوالی که ممکن است مطرح شود آن است که چه چیزی را نادیده گرفتهایم. قانونی باید برای تعیین جهت فرایند وجود داشته باشد.
این قانون، همان قانون دوم ترمودینامیک است. شاید از خود بپرسید آیا واقعا به قانونی برای تعیین جهت فرایند نیاز داریم. جهت تمام این فرایندها را با استفاده از درک شهودی خود میتوانیم تعیین کنیم. اگر پرسش مشابهی در ذهن خود دارید به مثالی که در ادامه آورده میشود، توجه کنید.
فرض کنید دو ماده شیمیایی را داخل محفظهای قرار میدهیم و صبر میکنیم تا با یکدیگر واکنش دهند. هدف از انجام این آزمایش آن است که بدانیم آیا دو مولکول کوچک آبیرنگ با یک مولکول بزرگ زردرنگ به منظور تشکیل مولکولی جدید واکنش میدهند یا خیر. آیا میدانید چه اتفاقی رخ میدهد؟ براساس درک شهودی نمیتوانید انجام واکنش شیمیایی را پیشبینی کنید. بنابراین، قانون دوم ترمودینامیک در اینجا به کمک شما میآید.

دو تعریف استاندارد برای قانون دوم ترمودینامیک وجود دارد. شاید آنها را شنیده باشید. هر بیان، معنای یکسانی دارد. اما هیچکدام از آنها برای استفاده مهندسی مناسب نیستند. شکل دیگری از قانون دوم ترمودینامیک به نام «نامساوی کلازیوس» (Clausius inequality) وجود دارد که برای مهندسان مناسب است:
$$\oint (\frac {\delta Q} {T} ) _ b \leq 0$$
این معادله، معادله انتگرالی کوچک با معنایی عمیق است. نامساوی کلازیوس بدان معنا است که اگر فرایند سیکلی، همانند یخچال، داشته باشیم و تمام گرمای مبادله شده در مرز را بر دمای مرز تقسیم کنیم، نتیجه بهدست آمده کمتر یا برابر صفر خواهد بود. این نامساوی بسیار جالب است:
$$\frac { Heat _ {\in}} { T _ { \in \, avg} } - \frac { Heat _ {out}} { T _ { out \, avg} } \leq 0$$
نامساوی بالا برای تمام فرایندهای سیکلی به کار برده میشود. برای آنکه این معادله کاربردیتر باشد، آن را به شکل معروف آنتروپی مینویسیم. آنتروپی از دو قسمت تشکیل شده است:
- قسمت اول که بینظمی را نشان میدهد.
- قسمت دوم اثر انتقال گرما را نشان میدهد.
بیشتر افراد بر این باور اشتباه تاکید دارند که آنتروپی به معنای بینظمی است. اما همانطور که در معادله بالا دیده شد، آنتروپی از قسمت دیگری نیز تشکیل شده است: اثر انتقال گرما. بنابراین، تغییرات آنتروپی در هر فرایندی میتواند به صورت جمع تولید آنتروپی و انتقال آنتروپی تعریف شود.
$$S_2 - S _ 1 = S _ { \prod } + ( int_{a}^{b} \frac { \delta Q } { T } ) _ b$$
اگر فرایندی به طور کامل برگشتپذیر باشد و هیچ اصطکاک و اختلاطی در آن نباشد، تولید آنتروپی یا $$S_{\prod}$$ برابر صفر خواهد بود. با استفاده از معادله بالا برای آنتروپی و نامساوی کلازیوس میتوانیم به صورت ریاضی اثبات کنیم که طی فرایند خودبهخودی، آنتروپی کیهان همواره افرایش مییابد.
$$\triangle S _ { universe} \geq 0$$
به این نکته توجه داشته باشید که تغییرات آنتروپی کیهان برابر مجموع تغییرات آنتروپی سیستم و آنتروپی محیط اطراف سیستم در نظر گرفته شده است. برای داشتن درک بهتری از معادله فوق و اصل افزایش آنتروپی، به مثالِ «لیوان چای داغ» توجه کنید. در این مثال میخواهیم بدانیم آیا چای داغ داخل لیوان گرما جذب میکند یا از دست میدهد. چای به عنوان سیستم انتخاب و هر چیزی غیر از چای به عنوان محیط اطراف در نظر گرفته میشود. فرض کنید دمای چای ۴۵ درجه سیلسیوس و دمای محیط اطراف آن برابر ۲۵ درجه سلسیوس است. فرض کنید چای گرمایی برابر ۱۰ ژول را از محیط اطراف خود جذب میکند. بنابراین، تغییرات آنتروپی چای داغ برابر مقدار گرمای جذب شده توسط چای تقسیم بر دما آن است.
$$\triangle S _ { universe } + \triangle S _ { system} + \triangle S _ { surr} \ \triangle S _ {system} = \frac { + 10 } { 45 + 273 } $$

محیط اطراف نیز به اندازه $$\triangle S _ {system} = \frac { + 10 } { 25 + 273 }$$ گرما از دست میدهد. بنابراین، تغییرات آنتروپی محیط اطراف برابر $$- \triangle S _ {system} = \frac { + 10 } { 25 + 273 }$$ خواهد بود. اگر تغییرات آنتروپی سیستم و محیط اطراف آن را با یکدیگر جمع کنیم، تغییرات آنتروپی کیهان بهدست میآید:
$$\triangle S _ { universe} = \frac{+ 10 }{45 + 273} + \frac{- 10 }{25 + 273} = - 0.00211 \frac { J } { K }$$
تغییرات آنتروپی کیهان، منفی بهدست آمده است. با توجه به قانون دوم ترمودینامیک، آنتروپی منفی غیرممکن است. اکنون فرض کنید، چای داغ گرما از دست میدهد. در این حالت، مقدار Q برابر ۱۰- ژول خواهد بود. بنابراین، تغییرات آنتروپی جهان برابر است با:
$$\triangle S _ { universe} = \frac{- 10 }{45 + 273} + \frac{+ 10 }{25 + 273} = + 0.00211 \frac { J } { K }$$
در این حالت، تغییرات آنتروپی جهان، مثبت خواهد بود. بر طبق قانون دوم ترمودینامیک، تغییرات آنتروپی مثبت، ممکن است. در نتیجه، بر طبق این قانون فهمیدیم که چای داغی که در محیط اتاق قرار دارد، گرما از دست میدهد و هیچ گرمایی از محیط اطراف دریافت نمیکند.
در ادامه، به مثال واکنش شیمیایی مطرح شده برمیگردیم. فرض کنید واکنش شیمیایی رخ میدهد و آنتروپی سیستم به اندازه $$\triangle S _ {system}$$ افزایش مییابد. بنابراین، سیستم مقداری گرما جذب میکند. به گرمای جذب شده توسط این سیستم، آنتالپی گفته میشود. تغییرات آنتروپی جهان را باید محاسبه کنیم.

همانطور که در مطالب بالا گفته شد، تغییرات آنتروپی جهان برابر مجموع تغییرات آنتروپی سیستم و محیط اطراف آن است و به صورت زیر نوشته میشود:
$$\triangle S _ { universe} = \triangle S _ {system} + \triangle S _ { surr}$$
تغییرات آنتروپی سیستم را داریم. تغییرات آنتروپی محیط اطراف چه مقدار است؟ اگر سیستم مقدار مشخصی گرما جذب کرده باشد، محیط اطراف دقیقا همان اندازه گرما از دست داده است. بنابراین، تغییرات آنتروپی محیط اطراف برابر $$\frac { - \triangle H } { T}$$ خواهد بود. در نتیجه، تغییرات آنتروپی جهان به صورت زیر نوشته میشود:
$$\triangle S _ { universe} = \triangle S _ {system} - \frac { \triangle H } { T } $$
اگر عبارت بالا بزرگتر از صفر باشد، واکنش شیمیایی رخ میدهد:
$$\triangle S _ {system} - \frac { \triangle H } { T } \geq 0$$
معادله بالا را به صورت گویاتری مینویسیم. از آنجا که مقدار T همواره مثبت است، اگر نامساوی فوق را در $$- T$$ ضرب کنیم، به صورت زیر نوشته میشود:
$$\triangle H - T \triangle S \leq 0 $$
هنگامی که $$\triangle H - T \triangle T$$ کوچکتر یا برابر صفر باشد، واکنش شیمیایی رخ میدهد. به عبارت $$\triangle H - T \triangle T$$ انرژی آزاد گیبس میگوییم و آن را به صورت $$\triangle G$$ نشان میدهیم. از اینرو، تغییرات انرژی گیبس سیستم کوچکتر یا برابر صفر خواهد بود. استفاده از تغییرات انرژی گیبس به جای اصل افزایش آنتروپی، چند مزیت دارد. یکی از مهمترین مزایا آن است که در صورت استفاده از انرژی آزاد گیبس، نگران اتفاقهای رخ داده در محیط اطراف سیستم نیستیم. بنابراین، به راحتی میتوانیم روی سیستم تمرکز و در مورد خودبهخودی بودن فرایندها صحبت کنیم.
تعاریف استاندارد قانون دوم ترمودینامیک چیست ؟
در مطالب بالا گفتیم دو تعریف استاندارد برای قانون دوم ترمودینامیک وجود دارد. در این بخش در مورد این تعریفها صحبت میکنیم.
تعریف اول قانون دوم ترمودینامیک چیست ؟
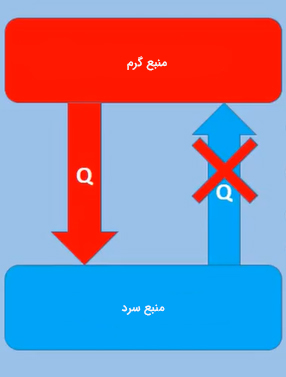
تعریف اول قانون دوم ترمودینامیک، تعریف کلازیوس نام دارد. بر طبق این تعریف، ساخت موتوری سیکلی یا چرخهای که تنها کار آن انتقال پیوسته گرما از منبعی با دمای بالاتر به منبعی با دمای پایینتر باشد، غیرممکن خواهد بود. به بیان سادهتر، ساخت یخچالی که بتواند انرژی را از منبعی با دمای کمتر (منبع سرد) دریافت و به منبع با دمای بالاتر (منبع گرم) انتقال دهد، بدون انجام کار امکانپذیر نیست.
تعریف دوم قانون دوم ترمودینامیک چیست ؟
تعریف دوم قانون دوم ترمودینامیک، تعریف کلوین-پلانک نام دارد. بر طبق این تعریف، ساخت موتور گرمایی سیکلی که بتواند کاری برابر گرمای جذب شده از منبع انجام دهد، امکانپذیر نخواهد بود. بازده چنین موتوری برابر ۱۰۰ درصد است، رویایی که بشر سالها است در آرزوی دستیابی به آن است، رویایی دستنیافتنی. به بیان دیگر، ماشین گرمایی نمیتواند تمام انرژی کسب شده از منبع گرمایی در یک چرخه را به کار تبدیل کند، بلکه قسمتی از انرژی دریافت شده از منبع گرم، به شکل انرژی تلف شده به منبع سرد داده میشود.
این فرایند در تصویر زیر نشان داده شده است. همانطور که در عکس مشاهده میشود، موتور سیکلی گرمایی برابر $$Q_ H$$ از منبع گرم دریافت میکند. موتور، قسمتی از $$Q_H$$ را به شکل کار به محیط اطراف و قسمتی از آن را به شکل انرژی اتلافی به منبع سرد میدهد.
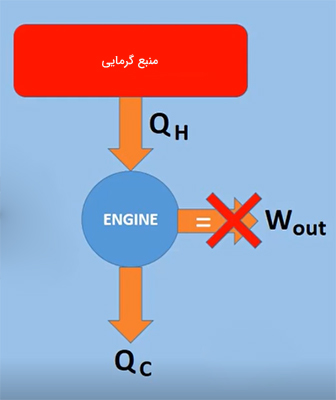
قانون دوم ترمودینامیک به هنگام آزمایشهای دانشمندی به نام «سعدی کارنو» (Sadi Carnot) روی موتورهای گرمایی، مطرح شد. موتور گرمایی، مانند موتور بخار در قرن نوزدهم میلادی، وسیلهای است که با استفاده از گرما، کار انجام میدهد. موتور بخار، گرما را از کوره ذغالسنگ دریافت و بخار تولید میکند. بخار ایجاد شده پیستون متصل به چرخهای قطار و در نتیجه قطار را به حرکت درمیآورد. بنابراین، کار انجام میشود. گرمای اضافی دریافت شده از منبع گرم که کار انجام نمیدهد، به منبع سرد منتقل خواهد شد. به یاد داشته باشید که دمای منبع سرد همواره کمتر از دمای منبع گرم است.
کارنو به این نتیجه رسید که بیشینه کار انجام شده در یک چرخه از موتور گرمایی برابر تفاضل گرمای وارد شده به سیستم و گرمای خارج شده از آن است. بر طبق قانون اول ترمودینامیک، گرمای اتلافی نمیتواند به کار تبدیل شود:
$$W_ { net} = Q _ H - Q _ C$$
اگر مقدار گرمای اتلافی برابر صفر باشد، تمام گرمای وارد شده به موتور به کار تبدیل میشود. بنابراین، بازده موتور برابر ۱۰۰٪ خواهد بود. همانطور که در مطالب بالا گفتیم، این حالت از نظر فیزیکی به چند دلیل غیرممکن است. یکی از مهمترین دلیلها عبارت است از، تنها راه برای رسیدن به بازده ۱۰۰٪ آن است که هر فرایندی داخل موتور به طور کامل برگشتپذیر باشد. این بدان معنا است که سیستم و محیط اطراف آن بتوانند به حالت اولیه خود بازگردند. به این حالت، اصل کارنو گفته میشود.
اما هر موتور واقعی از قسمتهای متحرک مختلفی تشکیل شده است که اصطکاک و صدا تولید میکنند. بنابراین، قسمتی از انرژی ورودی به موتور، تلف میشود. بیان دیگر اصل کارنو میگوید، گرما به صورت خودبهخود از جسمی با دمای بالاتر به جسمی با دمای پایینتر منتقل میشود. این عبارت میتواند به صورت دو رو از یک سکه در نظر گرفته شود. بنابراین، گرما نمیتواند به صورت خودبهخودی از منبع سرد به منبع گرم منتقل شود. گفتیم بیان دیگری به نام بیان آنتروپی نیز برای قانون دوم ترمودینامیک وجود دارد. بر طبق این بیان، هیچ سیستمی در جهان نمیتواند به گونهای عمل کند که آنتروپی از بین برود.
تا اینجا میدانیم بیانهای مختلفِ قانون دوم ترمودینامیک چیست. اجازه دهید، این قانون را به شکل بسیار سادهتری بیان کنیم.
زیاد به کم
جریان طبیعی در هر فرایندی همواره از مقدارهای انرژی بالا به انرژی پایین خواهد بود. به عنوان مثال، فنجانی قهوه داغ را در نظر بگیرید. دمای قهوه داخل فنجان از دمای فنجان بیشتر است. هر چه دما بالاتر باشد، انرژی سیستم بیشتر خواهد بود. بنابراین، گرما از قهوه به فنجان و محیط اطراف منتقل میشود. در مطالب بالا، مثال مشابهی را با یکدیگر بررسی کردیم. فرض کردیم گرما از محیط اطراف با دمای پایینتر به چای با دمای بالاتر منتقل میشود. آنتروپی در این حالت منفی بهدست آمد. از آنجا که آنتروپی همواره افزایش مییابد، انتقال گرما از محیطی با دمای بالاتر به محیطی با دمای کمتر، امکانپذیر نیست. به همین دلیل، گرما از قهوه با دمای بالاتر به فنجان با دمای کمتر منتقل میشود و دمای فنجان بالاتر میرود.
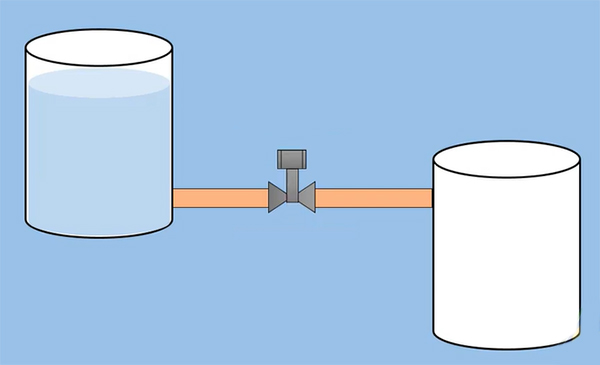
بادکنکی باد شده را در نظر بگیرید. سوراخ کوچکی در بادکنک ایجاد کنید. آیا هوای بیرون به داخل بادکنک منتقل میشود؟ خیر. هوای داخل بادکنک از آن خارج و به محیط اطراف وارد میشود. زیرا فشار هوای درون بادکنک بیشتر از فشار هوای بیرون از آن است. دو مخزن آب، یکی پر و دیگری خالی، را در نظر بگیرید. این دو مخزن را توسط شیری، به شکل نشان داده شده در تصویر زیر، به یکدیگر وصل میکنیم. در ابتدا، شیر اتصال بسته است، بنابراین هیچ اتفاقی رخ نمیدهد. اگر شیر را باز کنیم، چه اتفاقی رخ میدهد؟ ارتفاع آب در مخزن پر به آهستگی کاهش مییابد و پس از خروج از این مخزن به مخزن خالی وارد میشود.
حالت کامل، غیرممکن است
وجود اتلاف در هر فرایندی در دنیای واقعی امری اجتنابناپذیر است. به عنوان مثال، تمام سوخت داخل اتومبیل به انرژی مکانیکی تبدیل نمیشود. بخش از سوخت داخل اتومبیل صرف غلبه بر نیروی اصطکاک بین جاده و لاستیکها میشود. اگر توپی را محکم به زمین بزنید، تا ارتفاع مشخصی بالا میرود و دوباره به سطح زمین برخورد میکند و این کار تا توقف کامل توپ ادامه مییابد. ارتفاع توپ پس از هر برخورد آن به سطح زمین، کاهش مییابد. چرا؟ زیرا قسمتی از انرژی توپ به شکل انرژی اتلافی به زمین منتقل میشود.
آزمایش قانون دوم ترمودینامیک
آزمایشی را برای داشتن درک بهتری از قانون دوم ترمودینامیک در ادامه انجام میدهیم. بر طبق قانون دوم ترمودینامیک، در تمام مبادلات انرژی، اگر هیچ انرژی به سیستم وارد یا از آن خارج نشود، انرژی پتانسیل حالت نهایی همواره کمتر از حالت اولیه خواهد بود. به این تعریف، آنتروپی گفته میشود. فرض کنید دو سیستم با دماهای $$T_1$$ و $$T_2$$ داریم و $$T_1$$ بزرگتر از $$T_2$$ است. بنابراین، گرما از سیستم با دمای $$T_1$$ به سیستم با دمای $$T_2$$ منتقل میشود.
فرایندی طبیعی را در نظر بگیرید که از حالت تعادلی شماره یک آغاز میشود و در حالت تعادلی شماره دو به پایان میرسد. فرایند در جهتی پیش میرود که آنتروپی سیستم و محیط اطراف آن در فرایند برگشتناپذیر افزایش یابد. اگر فرایند برگشتپذیر باشد، آنتروپی ثابت باقی میماند.
وسایل موردنیاز برای انجام این آزمایش عبارت هستند از:
- شمع
- بادکنک
- فندک
- آب به مقدار لازم
آزمایش شماره یک
شمعی را داخل لیوانی به صورت ثابت قرار میدهیم و با استفاده از فندک آن را روشن میکنیم. در ادامه، بادکنک را تا رسیدن به اندازه متوسط باد و آن را گره میزنیم. بادکنک باد شده را بالای شمع نگه میداریم. چه اتفاقی برای بادکنک رخ میدهد؟ در این آزمایش، بادکنک پس از گذشت ۵ ثانیه منفجر میشود.

آزمایش شماره دو
در آزمایش دوم، مقداری آب داخل بادکنک میریزیم. بنابراین، در اولین گام مقداری آب داخل بادکنک ریخته میشود. سپس، بادکنک را باد میکنیم. به این نکته توجه داشته باشید که بادکنک را به اندازهای باد میکنیم که هماندازه با بادکنک در آزمایش شماره یک باشد. در ادامه، بادکنک باد شده حاوی آب را، همانند آزمایش شماره یک، بالای شمع روشن قرار میدهیم. چه اتفاقی رخ میدهد؟ در این آزمایش، بادکنک منفجر نمیشود، اما ته آن گرم است.
نتیجه
در آزمایش شماره یک، گرما از شمع به هوای داخل بادکنک منتقل میشود. هوا منبسط و بادکنک پس از چند ثانیه منفجر خواهد شد. در آزمایش دوم، نتیجه متفاوتی را مشاهده کردیم. در این آزمایش، گرما ابتدا به آب داخل بادکنک منتقل میشود. آب رسانای خوبی برای انتقال گرما است. آبِ نزدیکتر به شعله شمع، گرم میشود و ارتفاع آن افزایش مییابد. آبِ سردتر، گرمای بیشتری را جذب میکند و فرایند تکرار میشود. به دلیل فرایند همرفتی، بادکنک منفجر نمیشود.
تا اینجا میدانیم قانونهای اول و دوم ترمودینامیک چیست، در ادامه، مفهوم آنتروپی را با جزییات بیشتری توضیح میدهیم.
آنتروپی در ترمودینامیک چیست ؟
درک مفهوم آنتروپی بسیار مشکل است. بسیاری از افراد آنتروپی را همان بینظمی معنا میکنند و اعتقاد دارند آنتروپی معیاری از میزان بینظمی در جهان است. به بیان دیگر، بسیاری از افراد اعتقاد دارند آنتروپی، میزان بینظمی سیستم انتخاب شده را بیان میکند. مفهوم آنتروپی چیست؟ برای درک آنتروپی از معادله $$S = k _ B \ln (\Omega)$$ استفاده میکنیم. اما نگران معادلات ریاضی پیچیده در این قسمت نباشید. برای توضیح مفهوم آنتروپی سعی میشود از ریاضیات پیچیده دانشگاهی استفاده نشود.

جعبهای متشکل از تعدادی ذره (به عنوان مثال سه ذره) در نظر بگیرید. نوع ذرات مهم نیست، تنها نکته مهم آن است که هر ذره مقداری انرژی با خود حمل میکند. هر ذره، مقداری انرژی مشخص دارد و این مقدار توسط ترازهای انرژی نشان داده میشود. تراز شماره یک، کمترین مقدار انرژی که ذره میتواند داشته باشد را نشان میدهد. انرژی تراز شماره دو اندکی بیشتر از انرژی تراز شماره یک و انرژی تراز شماره ۳ اندکی بیشتر از انرژی تراز شماره ۲ است. هر چه شماره تراز افزایش یابد، مقدار انرژی هر تراز نیز افزایش خواهد یافت. برای سادگی فرض میکنیم کمترین تراز انرژی متناظر با ذرهای با انرژی E و تراز انرژی دوم متناظر با ذرهای با انرژی $$2 E$$ و ... است.
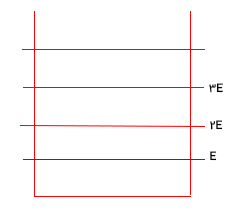
تعداد ترازهای انرژی اشغال شده توسط ذرات، بینهایت است. توجه به این نکته مهم است که ذرات باید کمینه انرژی به اندازه E داشته باشد انرژی بالاتر ذرات باید مضربی از E باشد. همچنین، این نکته را در نظر بگیرید که نمایش ترازهای انرژی به شکل نشان داده شده در تصویر بالا تنها راهی برای نشان دادن مقدار انرژی هر ذره است. یا گام به جلو میرویم. فرض کنید انرژی کل سیستم ما، جعبه، برابر $$5 E$$ باشد. این مقدار انرژی توسط ذرات و نه توسط دیوارههای جعبه، حمل میشود.
گفتیم در جعبه، سه ذره داریم. یعنی انرژی کل $$5 E$$ بین سه ذره تقسیم شده است. ذرههای داخل جعبه را A و B و C مینامیم. سوالی که ممکن است مطرح شود آن است که چه ترازهای انرژی برای رسیدن به انرژي کل $$5 E$$ توسط ذرات میتوانند اشغال شوند. راههای زیادی برای اشغال ترازهای انرژی توسط سه ذره وجود دارند.
برای پاسخ به این پرسش، فرض میکنیم ذره A در پایینترین تراز با کمترین مقدار انرژی، یعنی E، قرار گرفته است. ذره B را نیز مشابه ذره A در پایینترین تراز قرار میدهیم. جمع انرژی دو ذره A و B برابر $$2 E$$ و انرژی باقیمانده تا انرژی کل برابر $$3E$$ است. بنابراین، ذره C باید در ترازی با مقدار انرژي $$3E$$ قرار بگیرد. از اینرو، انرژی کل سیستم برابر $$5 E$$ میشود. سه ذره ممکن است ترازهای انرژی را به گونه دیگری نیز اشغال کنند. ممکن است ذره B، به جای ذره C در ترازی با انرژی $$3 E$$ قرار داشته باشد.در این صورت ذرههای A و C در پایینترین تراز انرژی قرار میگیرند. در حالت سوم، ذره A در تراز انرژی $$3E$$ و ذرههای B و C در پایینترین تراز انرژی قرار میگیرند. انرژی کل سیستم در تمام این حالتها برابر $$5 E$$ است.
ذرههای A و B و C ممکن است برای رسیدن به انرژی کل$$5 E $$ ترازهای انرژی را به گونه دیگری اشغال کنند. آنها ممکن است به جای قرار گرفتن در پایینترین و سومین تراز انرژی در پایینترین و دومین تراز انرژی قرار بگیرند. به عنوان مثال، ذره a میتواند در پایینترین تراز انرژی و دو ذره دیگر در دومین تراز با انرژی $$2E$$ قرار بگیرند. به همین ترتیب، با تغییر ذرات در هر تراز، دو حالت دیگر نیز بهدست میاید. بنابراین، ۶ راه متفاوت برای سیستم سه ذرهای برای رسیدن به انرژی کل $$5 E$$ وجود دارد.
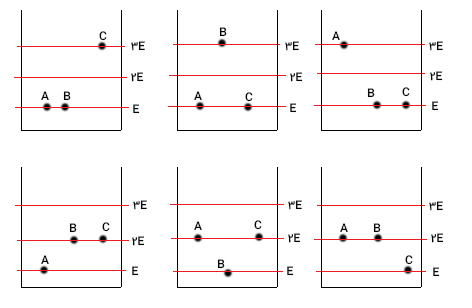
به هر یک از این ۶ راه برای قرار دادن ذرات در سیستم برای رسیدن به انرژی کل $$5E $$، «میکروحالت» (Microstate) گفته میشود. تعداد میکروحالتهای هر سیستمی به هنگام تعریف آنتروپی بسیار مهم است. بار دیگر معادلهای که در ابتدای این بخش بیان شد را مینویسیم:
$$S = k _ B \ln (\Omega)$$
در معادله بالا، $$\Omega$$ تعداد میکروحالتهای اشغال شده توسط سیستم، S آنتروپی سیستم و $$k_B$$ ثابت بولتزمن هستند. با توجه به معادله بالا، آنتروپی هر سیستم به تعداد میکروحالتهای اشغال شده توسط سیستم، بستگی دارد. بنابراین، به تعریف کلی آنتروپی میرسیم:
آنتروپی، معیاری از بینظمی هر سیستم است.
تعداد میکروحالتهای سیستم سه ذرهای با انرژی کل $$5 E$$ برابر ۶ و آنتروپی آن برابر $$S = k _ B \ln (6)$$ است. اکنون، فرض کنید انرژی کل سیستم سه ذرهای برابر $$3 E $$ است. در این حالت، سیستم تنها میتواند یک میکروحالت را اشغال کند. انرژی کل سیستم تنها هنگامی میتواند برابر $$3 E$$ باشد که هر سه ذره در پایینترین تراز انرژی قرار بگیرند. در این حالت، $$\Omega$$ برابر یک و آنتروپی آن برابر $$S = k _ B \ln (1)$$ است. از آنجا که $$\ln 1$$ برابر صفر است، آنتروپی برابر صفر میشود.

آنتروپی سیستم در حالت اول برابر $$2.47 \times 10 ^ { - 23 } \frac { J } { K}$$ است. به این سیستم، سیستم بینظم گفته میشود. ذرات در این سیستم میتوانند در حالتهای مختلفی قرار بگیرند. سیستمهای بینظم، آنتروپی بالاتری دارند. در حالت دوم، تعداد میکروحالتها و در نتیجه آنتروپی سیستم کمتر است. به این سیستم، سیستم منظم گفته میشود. به این نکته توجه داشته باشید که به هنگام محاسبه آنتروپی در حالت اول (سیستمی با انرژی کل $$5E$$) فرض کردیم سیستم با احتمال مساوی در هر یک از میکروحالتها گفته شده قرار میگیرد. این فرضیه یکی از فرضیههای بنیادی ترمودینامیک آماری است. این فرضیه را میتوان برای سیستمهای زیر در نظر گرفت:
- سیستمهایی که به طور کامل ایزوله هستند.
- سیستمهایی که در تعادل گرمایی قرار دارند.
از اینرو، توجه به این نکته مهم است که رابطه نوشته شده برای آنتروپی، یعنی $$S = k _ B \ln (\Omega)$$ رابطه اصلی برای این کمیت نیست. رابطه اصلی آنتروپی به صورت زیر نوشته میشود:
$$dS = \frac {\delta Q _ { rev} } { T }$$
معادله بالا بیشتر برای مقیاس ماکروسکوپی مناسب است. در این معادله، به سیستم به عنوان سیستمی کلی نگاه میکنیم. با استفاده از این معادله، به مشخصههای ماکروسکوپی سیستم مانند دما، فشار یا حجم نگاه میشود.
تا اینجا میدانیم قانونهای اول و دوم ترمودینامیک چیست. در ادامه، در مورد قانون سوم ترمودینامیک صحبت میکنیم.
قانون سوم ترمودینامیک چیست ؟
قانون سوم ترمودینامیک در مورد مفهوم عجیب دیگری به نام صفر مطلق صحبت میکند. دما میتواند بسیار بالا یا بسیار پایین باشد. شاید هیچ ایدهای در مورد سردترین دمای ممکن نداشته باشید. در مطالب بالا، در مورد دما و گرما صحبت کردیم. دما به صورت اندازهگیری انرژی گرمایی در دسترس، تعریف میشود. انرژی گرمایی برابر مجموع انرژی جنبشی سیستم است. با کاهش دما، انرژی درونی سیستم و در نتیجه انرژی جنبشی هر ذره کاهش مییابد. اگر دمای سیستم بسیار پایین بیاید، حرکت ذرات آهسته میشود و در نهایت متوقف میشوند. به بیان دیگر، با کاهش دما، انرژی جنبشی ذرات کاهش مییابد.
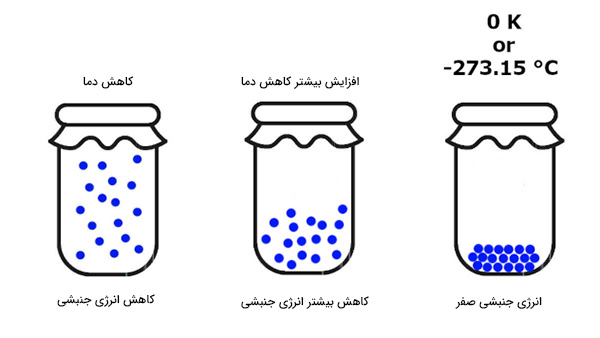
نبود انرژی جنبشی به معنای نبود دما است. اگر دما را به صورت مجموع انرژی جنبشی ذرات تشکیلدهنده سیستم تعریف کنیم، صفر بودن انرژی جنبشی به معنای دمای صفر است. به این دما، صفر مطلق گفته میشود و در آن انرژی جنبشی ذرات تشکیلدهنده سیستم برابر صفر است. در دمای صفر مطلق، هر جسمی، حتی هیدروژن و هلیوم، جامد هستند. قانون سوم ترمودینامیک را میتوان به صورت زیر نیز نوشت:
آنتروپی هر ماده کریستالی در صفر مطلق، برابر صفر خواهد بود.
جمله بالا، نتیجه مستقیم معادله بولتزمن، $$S = k _ B \ln (\Omega)$$، برای آنتروپی است. اگر انرژی جنبشی سیستم برابر صفر باشد، هیچ ذرهای حرکت نمیکند. بنابراین، تنها یک میکروحالت برای اشغال ذرات وجود دارد. از اینرو، $$\Omega$$ برابر یک و آنتروپی برابر صفر خواهند بود. سوالی که ممکن است مطرح شود آن است که آیا رسیدن به دمای صفر مطلق امکانپذیر است. در حقیقت، رسیدن به این دما امکانپذیر نیست. در نتیجه، قانون سوم ترمودینامیک را به صورت دیگری نیز میتوان نوشت:
کاهش دمای هر سیستمی به دمای صفر مطلق در تعداد گامهای محدود، غیرممکن است.
شاخه های ترمودینامیک چیست ؟
ترمودینامیک به چهار شاخه تقسیم میشود:
- ترمودینامیک کلاسیک
- ترمودینامیک آماری
- ترمودینامیک شیمیایی
- ترمودینامیک تعادلی
ترمودینامیک کلاسیک چیست ؟
یکی از هدفهای ترمودینامیک شیمیایی، پیشبینی امکان رخ دادن واکنشهای شیمیایی مختلف است. اما به این نکته توجه داشته باشید که ترمودینامیک شیمیایی هیچ ایدهای در مورد نرخ واکنشهای شیمیایی ندارد. حتی اگر بتوانیم بر طبق مطالعات ترمودینامیکی وقوع واکنشی شیمیایی را پیشبینی کنیم، باز نمیتوانیم بگوییم این واکنش در میلیثانیه رخ میدهد یا سرعت رخ دادن آن به قدری آهسته است که گویا هیچ تغییر انجام نمیشود.
علم ترمودینامیک بر پایه این ایده ساخته شده است که سیستم شیمیایی مشخصی میتواند توسط مقادیر توابع ترمودینامیکی خاصی مانند فشار، دما، حجم، غلظت، انرژی، آنتالپی، آنتروپی، انرژی آزاد گیبس، انرژی آزاد هلمهولتز، پتانسیل شیمیایی و فعالیت شیمیایی، مشخصهیابی شود.
ریشههای کلمه ترمودینامیک، ایده گرما و حرکت را منتقل میکنند. در حالت کلی، حرکت شامل انرژی جنبشی و کار مکانیکی است. تبدیل متقابل گرما و کار، کلید و مبحث اصلی علم ترمودینامیک در نظر گرفته میشود. با ایده تبدیل انرژی جنبشی به کار آشنا هستیم. با استفاده از تعدادی نخ و قرقره میتوان از افتادن جسمی برای بالا بردنی جسمی دیگر استفاده کنیم. انرژی جنبشی علاوه بر تبدیل به کار، به دلیل وجود نیروی اصطکاک در سیستم میتواند به گرما تبدیل شود. تبدیل انرژی جنبشی به گرما را میتوان به صورت دیگری نیز نگاه کرد، انرژی جنبشی جسمی بزرگ تبدیل به افزایش انرژی جنبشی اتمها و مولکولهای تشکیلدهنده جسم گرم شده میشود. اینکه گرم شدن جسمی، انرژی جنبشی اتمهای تشکیلدهنده آن را افزایش میدهد در نظریهای به نام نظریه جنبشی گرما گنجانده میشود.
فرایند میکروسکوپی فرایندی است که در مقیاس مولکولی یا اتمی رخ میدهد. اگر فرایند در مقیاسهای بزرگتر رخ رهد به آن فرایند ماکروسکوپی گفته میشود. فرایندهای ماکروسکوپی در ماده بالک (ماده در اندازههای بزرگ) مشاهده میشوند. اصطکاک، حرکت ماکروسکوپی را از بین میبرد و آن را به گرما تبدیل میکند. در این صورت میتوان گفت حرکت ماکروسکوپی به حرکت میکروسکوپی تبدیل میشود. ذکر این نکته مهم است که حرکتهای ماکروسکوپی را میتوان با استفاده از میکروسکوپ اپتیکی مشاهده کرد. حرکت براونی ذرات کلوییدی در محیط مایع به دلیل مشاهدهپذیر بودن آن، قابلتوجه است. اگر به حرکت براونی ذرهای با استفاده از میکروسکوپ اپتیکی نگاه کنیم، حرکت سریع و تصادفی ذره کلوییدی را مشاهده خواهیم کرد.
گرما میتواند به حرکت مکانیکی نیز تبدیل شود. سالها قبل، از موتورهای بخار برای به حرکت درآوردن وسایل مختلف استفاده میشد. در این موتورها، گرما به کار تبدیل میشود. برای کاربردهای روزمره، موتور احترافی داخلی جایگزین موتور بخار شد. هنگامی که برای ایجاد حرکت مکانیکی (کار) از موتور گرمایی استفاده میکنیم باید از مقدار گرمای ورودی به موتور برای انجام کار موردنظر آگاه باشیم. کارنو نخستی کسی بود که این مشکل را به صورت نظری، تحلیل کرد. حل این مشکل سبب کشف قانون دوم ترمودینامیک شد.
تبدیل گرما و کار از عدم تقارن مهمی تشکیل شده است. انرژی جنبشی میتواند به طور کامل به گرما تبدیل شود، زیرا مثالهای بیشماری از توقف کامل اجسام به دلیل وجود نیروهای اصطکاکی مشاهده کردهایم. اما سوالی که ممکن است مطرح شود آن است که آیا گرما میتواند به طور کامل به کار تبدیل شود یا خیر. پاسخ به این پرسش، خیر است و دلیل آن به قانون دوم ترمودینامیک برمیگردد.
تحت شرایط ایدهآل، گرما به طور کامل میتواند به کار تبدیل شود. فرض کنید گاز ایدهآلی را درون پیستون بدون اصطکاکی حبس و آن را با قرار دادن منبع گرمایی، گرم میکنیم. هنگامی که گاز گرم میشود،، حجم پیستون را به گونهای افزایش میدهیم که دمای گاز ثابت بماند. در این حالت، پیستون روی عامل خارجی کار انجام میدهد. مقدار کار انجام شده توسط پیستون برابر گرمای اضافه شده به گاز است. به این فرایند، فرایند همدمای برگشتپذیر گفته میشود. در این فرایند، هیچ چرخهای وجود ندارد. همچنین، حجم گاز در انتهای فرایند بیشتر از حجم آن در ابتدای فرایند است.
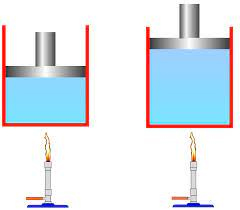
کارنو به این نتیجه رسید که موتور باید به صورت چرخهای کار کند. وسیلهای را در نظر بگیرید که به صورت چرخهای فعالیت میکند. این وسیله، حتی اگر به طور کامل ایدهآل و بدون اصطکاک باشد، نمیتواند به طور کامل و با بازدهی ۱۰۰٪ گرما را به کار تبدیل کند. کارنو، فرایند تبدیل گرما به کار را با استفاده از موتور گرمایی ایدهآل تحلیل کرد. این موتور گرما را از منبعی با دمای بالا دریافت میکند و به دو صورت آن را مصرف میکند:
- قسمتی از این گرما صرف انجام کار روی محیط اطراف میشود.
- باقی انرژی گرمایی به منبع با دمای کمتر داده میشود.
ترمودینامیک آماری چیست ؟
ترمودینامیک آماری نظریهای است که سعی میکند با استفاده از ویژگیهای مولکولی، کمیتهای ماکروسکوپی ترکیبهای مختلف را پیشبینی کند. با آنکه منشا ترمودینامیک آماری به پیش از فیزیک کوانتوم برمیگردد، در ترمودینامیک آماری پیشرفته فرض میشود که ترازهای انرژی سیستمی مشخص، گسسته هستند. با استفاده از دادههای تراز انرژی میتوان کمیتی وابسته به دما به نام «تابع پارش» (Partition Function) را محاسبه کرد. تمام مشخصههای ترمودینامیکی سیستم را با استفاده از این تابع میتوان بهدست آورد. برای بهدست آوردن تابع پارش مولکولی در ترمودینامیک آماری از ترازهای انرژی مولکولی تک آغاز میکنیم.
در ادامه، ویژگیهای سیستمی متشکل از N مولکول غیربرهمکنشی را محاسبه میکنیم. توجه به این نکته مهم است که تابع پارش سیستمی متشکل از مولکولهای برهمکنشی نیز با روش مشابهی بهدست میآید.
از ترمودینامیک آماری میتوان برای پیشبینی نرخهای واکنش نیز استفاده کرد. به این کاربرد، «نظریه حالت گذار» (Transition state transition) گفته میشود. در اصل، باید بتوانیم نرخ هر واکنشی را پیشبینی کنیم. برای انجام این کار کافی است معادلات مکانیک کوانتوم را به منظور بهدست آوردن ترازهای انرژی واکنشدهندهها و ساختارهای شیمیایی گذرا به نام حالت گذار را در واکنش بهدست آوریم. با داشتن ترازهای انرژی میتوانیم به راحتی توابع پارش و با استفاده از این تابع، مشخصات ترمودینامیکی را محاسبه کنیم.
در پایان، با داشتن توابع ترمودینامیکی میتوانیم نرخ واکنش را بهدست آوریم. محاسبات مکانیک کوانتومی تنها راه محاسبه ترازهای انرژی برای بهدست آوردن توابع پارش نیست. در مولکولهای کوچک این اطلاعات را میتوان با استفاده از دادههای اسپکتروسکوپی بهدست آورد. در این حالت، نظریه ترمودینامیک آماری به ما کمک میکند تا مشخصههای ترمودینامیکی را با استفاده از اندازهگیریهای اسپکتروسکوپی محاسبه کنیم.

ترمودینامیک شیمیایی چیست ؟
در ترمودینامیک شیمیایی در مورد رابطه بین کار و گرما در واکنشهای شیمیایی مطالعه میشود. این شاخه از ترمودینامیک به شیمیدانها میگوید:
- آیا واکنش شیمیایی نوشته شده از نظر انرژی در همان جهت پیشبینی شده انجام میشود یا خیر.
- آیا واکنش شیمیایی، ترکیبهای واکنش شیمیایی را در حالت تعادل میدهد یا خیر.
همانطور که در مطالب بالا گفته شد، با استفاده از ترمودینامیک شیمیایی نمیتوانیم با قطعیت بگوییم واکنش شیمیایی که از نظر انرژی انجامپذیر است، به طور دقیق همانگونه که در کاغذ نوشته شده است، انجام میشود یا خیر. همچنین، ترمودینامیک هیچ ایدهای در مورد نرخ واکنشهای شیمیایی به ما نمیدهد. ترمودینامیک شیمیایی، به عنوان پلی بین ویژگیهای ماکروسکوپی ماده و ویژگیهای مولکولها و اتمهای تشکیلدهنده آن، فراهم میکند. ترمودینامیک به ما میگوید چرا گرافیت میتواند به الماس تبدیل شود یا چگونه انرژی شیمیایی ذخیره شده در مولکولها میتواند برای انجام کار استفاده شود.
ترمودینامیک تعادلی چیست ؟
ترمودینامیک تعادلی در مورد تبادلات انرژی و ماده به هنگام نزدیک شدن به حالت تعادل، مطالعه میکند. واکنش تعادلی را به شکل کلی زیر در نظر بگیرید:
$$a A + b B \rightleftharpoons c C + d D$$
در واکنش بالا A و B و C و D گونههای واکنشدهنده و a و b و c و d ضریبهای استوکیومتری در واکنش هستند. طبق قرارداد، گونههای قرار گرفته در سمت چپ واکنش تعادلی بالا را واکنشدهندهها و گونههای قرار گرفته در سمت راست واکنش تعادلی فوق را محصولات واکنش مینامیم. توجه به این نکته مهم است که نوشتن واکنش به صورت بالا به معنای تضمین انجامپذیر بودن واکنش نیست. بسته به شرایط اولیه، واکنش ممکن است به سمت چپ یا راست حرکت کند و یا در حالت تعادلی قرار بگیرد. یکی از هدفهای ترمودینامیک شیمیایی، درک مفهوم عاملهای تعیینکننده موقعیت نهایی تعادلی واکنش است.
واکنش شیمیایی به سمتی پیش میرود که انرژی آزاد کل کمتر شود. در دما و فشار ثابت، انرژی آزاد واکنش با استفاده از انرژی آزاد گیبس بهدست میآید:
$$\triangle G = \triangle H - T \triangle G$$
در رابطه بالا:
- T دما برحسب کلوین است.
- $$\triangle G$$ تفاوت در انرژی آزاد گیبس بین واکنشدهندهها و محصولات واکنش است.
- $$\triangle H$$ تفاوت در آنتالپی بین واکنشدهندهها و محصولات واکنش است.
- $$\triangle S$$ تفاوت آنتروپی بین واکنشدهندهها و محصولات واکنش است.
آنتالپی چیست ؟
آنتالپی معیاری از جریان انرژی، به عنوان گرما، هنگام واکنش شیمیایی است. اگر گرما به هنگام انجام واکنش شیمیایی آزاد شود، $$\triangle H$$ منفی و واکنش گرماده است. در مقابل، واکنش گرماگیر از محیط اطراف گرما دریافت میکند و تغییرات آنتالپی آن مثبت خواهد بود.
آنتروپی در واکنش شیمیایی چیست ؟
آنتروپی معیاری از انرژی غیرقابلدسترس برای کارهای مفید و شیمیایی است. آنتروپی گونههای تکی، همواره مثبت و به طور کلی مقدار آن برای گازها بزرگتر از مقدار آن برای مواد جامد خواهد بود. همچنین، آنتروپی مولکولهای پیچیدهتر، بزرگتر از مقدار آن برای مولکولهای سادهتر است. به طور کلی، تغییرات آنتروپی در واکنشهایی که تعداد زیادی محصولات گازی و ساده تولید میکنند، مثبت خواهد بود. علامت $$\triangle G $$ جهت انجام واکنش شیمیایی را برای رسیدن به حالت تعادل نشان میدهد.
واکنش شیمیایی هنگامی از نظر ترمودینامیکی قابل انجام است که $$\triangle H$$ کاهش و $$\triangle S$$ افزایش یابد. با قرار دادن نامساویهای $$\triangle H <\; 0$$ و $$\triangle S >\; 0$$ در معادله $$\triangle G = \triangle H - T \triangle G$$ به این نتیجه میرسیم که معادله شیمیایی هنگامی از نظر ترمودینامیکی قابل انجام است که تغییرات انرژی آزاد گیبس منفی باشد. هنگامی که $$\triangle G$$ مثبت باشد، واکنش شیمیایی نوشته شده از نظر ترمودینامیکی قابل انجام نیست.
اگر واکنش شیمیایی در حالت تعادل باشد، تغییرات انرژی آزاد گیبس آن برابر صفر خواهد بود. علامت $$\triangle G$$ به علامتهای $$\triangle H$$ و $$\triangle S$$ بستگی دارد. شاید از خود بپرسید پس علامت دما چه میشود. از آنجا که دما برحسب کلوین بیان میشود، علامت آن همواره مثبت خواهد بود. جدول زیر تمام حالتهای ممکن را نشان میدهد.
| $$\triangle H$$ | $$\triangle S$$ | $$\triangle G$$ |
| - | + | تغییرات انرژی آزاد گیبس در تمام دماها، منفی خواهد بود. |
| - | - | تغییرات انرژی آزاد گیبس در دماهای پایین، منفی خواهد بود. |
| + | + | تغییرات انرژی آزاد گیبس در دماهای بالا، منفی خواهد بود. |
| + | - | تغییرات انرژی آزاد گیبس در تمام دماها، مثبت خواهد بود. |
به این نکته توجه داشته باشید که عبارت «دماهای بالا» و «دماهای پایین» به واکنش شیمیایی بستگی دارد. هنگامی که واکنش از حالت اولیه و غیرتعادلی به سمت موقعیت تعادلی خود حرکت میکند، مقدار $$\triangle G$$ به صفر نزدیک میشود. همزمان، غلظت گونههای شیمیایی نیز تغییر میکند. بنابراین، انرژی آزاد گیبس باید تابعی از غلظت واکنشدهندهها و محصولات واکنش باشد.
انرژی آزاد گیبس را میتوان به صورت زیر نوشت:
$$\triangle G = \triangle G ^ o + R T \ln Q _ r$$
همانطور که در معادله بالا دیده میشود، انرژی آزاد گیبس به دو بخش تقسیم شده است:
- $$\triangle G ^ o$$: این عبارت، تغییرات انرژی آزاد گیبس هنگامی است که واکنش در شرایط استاندارد خود قرار دارد. شرایط استاندارد به صورت زیر تعریف میشود:
- فشار جزیی گازها، واحد است.
- غلظت حلشوندهها، واحد است.
- مایعات و جامدات، خالص هستند.
- $$R T \ln Q _ r$$: این بخش از ضریب واکنش، یعنی $$Q_r$$، تشکیل شده است. در محاسبه ضریب واکنش، حالت غیراستاندارد فشار و غلظت در نظر گرفته میشود. $$Q _ r$$ برای واکنش $$a A + b B \rightleftharpoons c C + d D$$ به صورت زیر نوشته میشود:
$$Q _ r = \frac {[ C ] ^ c [ D ] ^ d } { [A ] ^ a [ B ] ^ b }$$
در رابطه بالا، عبارتهای قرار گرفته در براکتها، غلظتهای واکنشدهندهها و محصولات واکنش هستند. به این نکته توجه داشته باشید که در رابطه نوشته شده برای ضریب واکنش، غلظت محصولات در صورت کسر و غلظت واکنشدهندهها در مخرج آن نوشته شدهاند. همچنین، غلظت هر گونه به توان استوکیومتری آن در واکنش تعادلی شیمیایی رسیده است. اگر واکنشدهندهها و محصولات واکنش در حالت گازی قرار داشته باشند، به جای غلظت از فشار جزیی استفاده میکنیم. مایعات و جامدات خالص در معادله ضریب واکنش ظاهر نمیشوند.
همانطور که در مطالب بالا گفتیم، انرژی آزاد گیبس در حالت تعادل برابر صفر است، بنابراین معادله $$\triangle G = \triangle G ^ o + R T \ln Q _ r$$ به صورت $$ \triangle G ^ o = - R T \ln K$$ نوشته میشود. $$K$$ ثابت تعادل نام دارد و موقعیت تعادلی واکنش را تعریف میکند. ثابت تعادلی همان مقدار عددی ضریب واکنش است، تنها با این تفاوت که غلظتها در رابطه ضریب واکنش با غلظتهای تعادلی جایگزین شدهاند:
$$Q _ r = \frac {[ C ] ^ c _ { eq} [ D ] ^ d _ { eq} } { [A ] ^ a _ { eq} [ B ] ^ b _ { eq}}$$
کاربردهای ترمودینامیک در زندگی روزمره چیست ؟
تا اینجا میدانیم ترمودینامیک چیست. همچنین، در مورد چهار قانون آن صحبت کردیم. سوالی که ممکن است مطرح شود آن است که ترمودینامیک چه کاربردهایی در زندگی روزمره میتواند داشته باشد. در این بخش، برخی از کاربردهای ترمودینامیک در زندگی روزمره را توضیح میدهیم.
ذوب یخ
بیشتر دانشآموزان میدانند که چگونه مانع از شارش گرما شوند. اما سوالی که ممکن است مطرح شود آن است که تحت چه شرایطی رسانندگی گرما افزایش مییابد. فرض کنید دو منبع گرمایی ساده یکی از جنس آلومینیوم و دیگری از جنس فوم، به شکل زیر داریم. اگر دو قطعه یخ یکسان را روی هر یک از منبعهای گرمایی قرار دهیم، کدامیک سریعتر ذوب میشود؟

پس از قرار دادن قطعههای یخ روی هر یک از منبعهای گرما میبینیم قطعه یخ روی منبع گرمایی آلومینیومی به سرعت شروع به ذوب شدن میکند. در حالی که، قطعه یخ قرار گرفته روی منبع گرمایی فوم با نرخ بسیار کوچکی ذوب میشود. بنابراین، آلومینیوم رسانای گرمایی بسیار خوبی است. فرض کنید در روز گرمی در تابستان، برای نوشیدی لیوانی آب سرد مقداری یخ داخل آب میاندازید. دمای یخ از آب کمتر است، بنابراین از آن گرما دریافت میکند و شروع به ذوب شدن میکند. پس از گذشت مدت زمانی مشخص، تمام یخ داخل آب، ذوب میشود. این فرایند طبق قانونهای اول و دوم ترمودینامیک رخ میدهد.
عرق کردن در اتاقی شلوغ
اگر در اتاقی شلوغ باشید، ممکن است به دلیل ازدحام جمعیت و نبود هوای کافی شروع به عرق کردن کنید. در این حالت، بدن به وسیله انتقال گرمای خود به عرق، خنک خواهد شد. عرق بدن تبخیر میشود و مقداری گرما به محیط اتاق منتقل میکند. این اتفاقات به دلیل قانونهای اول و دوم ترمودینامیک رخ میدهند. این نکته را در ذهن داشته باشید که گرما از بین نمیرود، بلکه از محیطی به محیط دیگر منتقل میشود.

شاید از شنیدن این جمله تعجب کنید، ما از اصول ترمودینامیک برای موفقیت و شادی استفاده میکنیم. باور ندارید؟ برای آنکه بدانید چگونه، کمی صبور باشید. شما و خانوادهتان سیستم تطبیقی پیچیدهای هستید که در هر زمان مقدار محدودی انرژی دارید. برای رسیدن به موفقیت، انجام کارهای روزمره و زنده ماندن باید غذا مصرف کنید. همچنین، نیاز به دریافت محرک احساسی و ذهنی از محیط اطراف دارید.
در اینجا نقش آنتروپی بسیار مهم است. آنتروپی معیاری برای اندازهگیری از هم پاشیدن هر چیزی در زندگی یا کار است (قانون دوم ترمودینامیک). هرچه آنتروپی بزرگتر باشد، نرخ زوال زندگی و کار سریعتر خواهد بود. هر کسی ابتدا باید از انرژی درونی خود برای کنترل آنتروپی استفاده کند. تنها در این صورت فرد میتواند در دنیای خارج به موفقیت و خوشحالی برسد.
بهترین کتاب های ترمودینامیک چیست ؟
تا اینجا میدانیم ترمودینامیک و قوانین حاکم بر آن چیست. در این بخش، بهترین کتابهای نوشته شده در زمینه ترمودینامیک را معرفی میکنیم این لیست از کتابها براساس توصیه برخی فیزیکدانها، اطلاعات فروش و نظرسنجی از هزاران خواننده تهیه شده است.
سخنرانی های فاینمن در مورد فیزیک
در این کتاب، بخشی از مهمترین و جالبترین سخنرانیهای «ریچارد فاینمن» (Richard Feynman) در مورد اپتیک، کوانتوم و ترمودینامیک جمعآوری شده است. این کتاب رتبه اول را در بخش کتابهای علمی برای کودکان و اپتیک در فیزیک کسب کرده است. «بیک گیتس» (Bill Gates) در مورد این کتاب میگوید، برای یادگیری فیزیک لازم نیست حتما آن را در مدرسه یا دانشگاه بیاموزیم. اگر فرد سختکوشی هستید، کتاب فاینمن را بخوانید و مسئلههای فیزیک را حل کنید.
همچنین، «دیوید بِینبریج» (David Bainbridge) در مورد فاینمن میگوید، به نظرم او یکی از باهوشترین و بااستعدادترین افرادی است که در قرن بیستم میلادی زندگی کرده است. این فیزیکدان علیرغم نبوغ بالایش، معلم بسیار خوبی نیز است . ترکیب این دو در کنار هم بسیار عجیب به نظر میرسد. برخی از رتبههای این کتاب در بخشهای مختلف فیزیک عبارت است از:
- رتبه هشتم در مهندسی هوافضا
- رتبه ۶۱ در نجوم
- رتبه ۲ در نظریه آشوب
- رتبه ۱ در مهندسی شیمی
- رتبه ۱ در رشته شیمی
- رتبه ۶۰ در کیهانشناسی
- رتبه ۲ در مکانیک کلاسیک
- رتبه ۳ در مهندسی برق
- رتبه ۵ در نسبیت عام
- رتبه ۲ در گرانش
- رتبه ۲ در علوم مواد
- رتبه ۱ در شیمی آلی
- رتبه ۷ در فیزیک
- رتبه ۳ در فیزیک هستهای
- رتبه ۱ در ترمودینامیک
- رتبه ۸ در امواج
از اینرو، خواندن این کتاب به شدت به علاقهمندان به فیزیک توصیه میشود.

آشنایی با ترمودینامیک
این کتاب توسط «اچ. سی. ون نِس» (H. C. Van Ness) به رشته تحریر درآمده و در مبحث ترمودینامیک رتبه دوم را کسب کرده است. برخی از مزیتهای این کتاب عبارت هستند از:
- مباحث ترمودینامیک با زبانی ساده توضیح داده شدهاند.
- زبان استفاده شده در این کتاب غیررسمی است.
- در این کتاب از مثالهای کاربردی و بسیار جذاب استفاده شده است.
- این کتاب برای دانشجویان، مهندسان و هر فرد علاقهمند به ترمودینامیک قابلفهم است.

ترمودینامیک
این کتاب توسط «انریکو فرمی» (Enrico Fermi) به رشته تحریر درآمده و در مبحث ترمودینامیک رتبه پنجم را کسب کرده است. برخی از ویژگیهای این کتاب عبارت هستند از:
- مباحث به دقت بالایی انتخاب شده و با نظم خاصی دستهبندی شدهاند.
- گرچه نویسنده فرض کرده که خواننده با مباحث پایه ترمودینامیک آشنا است، برای توضیح قوانین ترمودینامیک از ریاضیات پیشرفتهای استفاده نکرده است.
در این کتاب مباحثی مانند سیستمهای ترمودینامیکی، قانون اول ترمودینامیک (کاربرد، فرایندهای آدیابتیک یا بیدرو)، قانون دوم ترمودینامیک (چرخه کارنو، دمای مطلق ترمودینامیکی، موتورهای گرمایی)، آنتروپی (ویژگیهای چرخه، آنتروپی سیستمی که حالتهای آن را میتوان روی نمودار حجم برحسب فشار نمایش داد، معادلات واندوالس)، پتانسیلهای ترمودینامیکی (انرژی آزاد، پتانسیل ترمودینامیکی در فشار ثابت، قانون فاز، ترمودینامیک سلول الکتریکی برگشتپذیر)، واکنش گازها (تعادلات شیمیایی در گازها، جعبه واکنشی «ون هوف» (Van's Hoff))، ترمودینامیک محلولهای رقیق (فشار اسمزی) و ثابت آنتروپی توضیح داده شدهاند.

آشنایی با ترمودینامیک آماری
این کتاب توسط «تِرِل هیل» (Terrell L. Hill) به رشته تحریر درآمده و در مبحث ترمودینامیک رتبه ششم را کسب کرده است. در قسمت اول این کتاب، نویسنده در مورد مکانیک آماری کوانتومی توضیح میدهد.
در قسمت دوم، سیستمهای متشکل از مولکولهای مستقل یا زیرسیستمهای مستقل بررسی میشوند. قسمت سوم در مورد سیستمهای متشکل از مولکولهای برهمکنشی توضیح میدهد. در قسمت چهارم مباحثی مانند آمار فرمی-دیراک و بوز-اینشتین، گاز فوتونی و نظریه حجم آزاد مایعات کوانتومی، توضیح داده شدهاند.

مبانی فیزیک، مکانیک، نسبیت و ترمودینامیک
این کتاب توسط «شانکار» (R. Shankar)، فیزیکدانی معروف و معلمی مشتاق، به رشته تحریر درآمده است. او نخستین کسی بود که دورهای را در برنامه خلاقانه «Open Yale Course» ارائه کرد. دورههای آنلاین شانکار در مورد آشنایی با فیزیک، میلیونها بار مشاهده شده است. کتاب مبانی فیزیک براساس دورههای آنلاین این پروفسور و توسط خود او تهیه شده است. او در این کتاب، مبانی فیزیک را از فیزیک گالیله و نیوتن تا ایدههای انقلابی مطرح شده در فیزیک در قرن بیستم میلادی، نسبیت و فیزیک کوانتوم، را توضیح میدهد. این کتاب با سادهترین سطح آغاز میشود. این کتب برای علاقهمندان به فیزیک و دانشآموزانی که مشتاق تحصیل در رشته فیزیک هستند، گزینه بسیار مناسبی به نظر میرسد.

قوانین ترمودینامیک
این کتاب توسط «پیتر اتکینر» (Peter Atkins) به رشته تحریر درآمده و در مبحث ترمودینامیک رتبه نهم و در مبحث شیمی رتبه هشتادوهفتم را کسب کرده است. همانطور که در مطالب بالا گفتیم ترمودینامیک از چهار قانون تشکیل شده است:
- قانون صفرم ترمودینامیک
- قانون اول ترمودینامیک
- قانون دوم ترمودینامیک
- قانون سوم ترمودینامیک
این قوانین هدایتکننده هر اتفاقی در کیهان هستند. از انبساط ناگهانی ابری از گاز تا سرد شدن فلزی داغ، با استفاده از این چهار قانون توضیح داده میشوند. در این کتاب، قوانین ترمودینامیک به صورت خلاصه و جامع، بدون استفاده از ریاضیات، توضیح داده شدهاند. در صورتی که با قوانین ترمودینامیک آشنا باشید، پس از خواندن این کتاب تمام مطالب را دوره کردهاید. اگر با این قوانین آشنا نباشید، پس از خواندن این کتاب، قوانین ترمودینامیک را به صورت کلی فرا خواهید گرفت.

قانون دوم
این کتاب توسط «پیتر اتکینر» (Peter Atkins) به رشته تحریر درآمده و در مبحث ترمودینامیک رتبه یازدهم را کسب کرده است. در این کتاب فوقالعاده، عملکرد جهان براساس انرژی توضیح داده میشود. در مطالب بالا گفتیم قانون دوم ترمودینامیک دو تعریف به نامهای تعریف کلازیوس و کلوین-پلانک دارد. قانون دوم ترمودینامیک براساس هر یک از این دیدگاهها در این کتاب بررسی شده است.

قدرتمندترین ایده در جهان
این کتاب توسط «ویلیام روزن» (William Rosen) به رشته تحریر درآمده و در مبحث ترمودینامیک رتبه یازدهم را کسب کرده است. بیل گیتس پس از مطالعه این کتاب، یکی از طرفداران پروپاقرص آن شد. در این کتاب، ترمودینامیک از قرن هجدهم میلادی تاکنون به زبان ساده توضیح داده شده است.

پرسش های رایج در مورد ترمودینامیک
تا اینجا، میدانیم قوانین ترمودینامیک چیست و مفهوم آنها را به صورت کلی توضیح دادیم. در ادامه، به چند پرسش در مورد ترمودینامیک پاسخ میدهیم.
چرا قوانین ترمودینامیک مهم هستند؟
قوانین ترمودینامیک، کمیتهای فیزیکی مانند دما، انرژی و آنتروپی را تعریف میکنند. با استفاده از این کمیتها میتوان، سیستمهای ترمودینامیکی را در تعادل حرارتی مشخصهیابی کرد.
مثال کار منفی چیست؟
هنگامی که جسمی را روی زمین میکشیم، کار انجام شده توسط اصطکاک جنبشی، منفی است.
در پنکه انرژی الکتریکی به انرژی مکانیکی تبدیل میشود، این تبدیل را میتوان توسط کدام قانون توضیح داد؟
این تبدیل توسط قانون اول ترمودینامیک توضیح داده میشود.
جمعبندی
با مطالعه این مطلب میتوانیم به پرسشهای زیر پاسخ دهیم:
- ترمودینامیک چیست و چه کاربردی در زندگی روزمره دارد.
- چهار قانون ترمودینامیک چیست و چه مفاهیمی را توضیح میدهند.
- دستهبندی و شاخههای ترمودینامیک چیست.
- معروفترین کتابها در زمینه ترمودینامیک چیست.











مطلب خیلی مفیدی بود
پیروز و پرانرژی باشین
صفرتاصد نبود?
عالی مثل همیشه
عالی بود
بسیار عالی و کاربردی
با سلام.
واقعا مطالب کارآمد و سادهدسازی و قابل فهم بود.
خدا خیرتون بده 🙏🏻🙏🏻
سلام خدمت همه اساتید و بزرگواران مجله فرادرس
امید است که با توان و قدرتی فراگیر به کار خویش ادامه دهید
بنده به قطع میتوانم بگویم که در حیطه ریاضیات فیزیک و برنامه نویسی اطلاعات شما دقیق تر خواناتر و بالنده تر از دانشنامه های دیگر نظیر ویکی پدیا و … است
امیدوارم پاینده باشید و خوش و به کار خود به خوبی ادامه دهید ????????
.
عالی
ممنون از مطالب مفید و خوب شما
من با ذکر نام و آدرس این صفحه از مطالب ترمودینامیک استفاده میکنم.
انشاالله موفق باشید