اوربیتال مولکولی — به زبان ساده
مدل اوربیتال مولکولی از جمله مهمترین مدلهای پیوند شیمیایی به شمار میآید. این مدل به عنوان پایه بیشتر محاسبات مقداری محسوب میشود. نظریه اوربیتال مولکولی شامل ریاضیات بسیار پیچیدهای است اما فهم بنیادی آن بسیار ساده است که در این بخش قصد داریم به آن بپردازیم.
نظریه اوربیتال مولکولی با نظریه وسپر و ساختار لوییس به طور کامل تفاوت دارد چراکه این دو مدل بر پایه یک اوربیتال مرکزی در یک اتم تنها بنا شدهاند. در مدل «هیبرید شده» (Hybridization) بیان میشود که این اوربیتالهای اتمی به هنگام برهمکنش با سایر اتمها دچار تغییراتی میشوند. تمامی این مدلها که به مدل «پیوند والانس» (Valance Bond) موسوم هستند، کاربردی محدود دارند چراکه در شناخت توزیع الکترونها موفق نیستند.
اوربیتال مولکولی
یک پیوند شیمیایی زمانی اتفاق میافتد که نیروهای خالص جاذبه بین یک الکترون و دو هسته، بیشتر از دافعه الکترواستاتیک بین دو هسته شوند. برای اینکه چنین اتفاقی رخ دهد، الکترون در ناحیهای باید قرار بگیرد که به آن، «منطقه پیوندی» (Binding Region) میگویند. بهعکس، اگر الکترونی در طرفی دیگر و در منطقه ضدپیوندی قرار داشته باشد، موجب ایجاد دافعه بین دو هسته میشود و آندو را از یکدیگر دور میکند.
سادهترین راه برای تصور یک اوربیتال مولکولی رسم دو اتم مجزا و اوربیتالهای الکترونی اطراف آن است. در ادامه رسم این اوربیتالها، سعی میکنیم که نحوه برهمکنش این اوربیتالها را با نزدیک کردن آنها به یکدیگر بیاموزیم. در نهایت، هسته دو اتم به فاصلهای میرسند که با فاصله بین دو هسته مولکول مورد نظر برابر است. در نهایت، اوربیتالی که تشکیل میشود، به نام اوربیتال مولکولی شناخته میشود.
سادهترین مولکول
برای بررسی اوربیتالهای مولکولی، سادهترین مولکول ممکن، یعنی یون مولکول هیدروژن $$({H_2^{+}})$$ را بررسی میکنیم. این مولکول شامل دو هسته با بار $$+1$$ و یک الکترون اشتراکی بین آندو است.
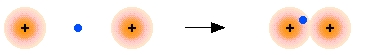
با نزدیک شدن دو هسته هیدروژن به یکدیگر، اوربیتالهای اتمی $$1s$$ نیز به یک اوربیتال مولکولی تبدیل میشوند. در این اوربیتال، چگالی الکترونی بین دو هسته قرار میگیرد. از آنجایی که این اوربیتال، محلی است که در آن الکترون، بیشترین نیروی جاذبه را به طور همزمان به دو هسته وارد میکند، به چنین آرایشی، اوربیتال مولکولی پیوندی میگویند. چنین اوربیتالی با خط تقارن بین دو هسته را، اوربیتال سیگما $$(\sigma)$$ مینامند.
اوربیتالهای مولکولی پیوندی و ضد پیوندی
مشکلی که در اینجا مطرح میشود، این است که ما با دو اوربیتال اتمی کار را شروع کردیم اما در نهایت به یک اوربیتال رسیدیم. بر طبق قوانین مکانیک کوانتومی، اوربیتالها به دلخواه ما ایجاد یا ناپدید نمیشوند. همچنین این سوال پیش میآید که در چه فاصلهای، دو اوربیتال را به یک اوربیتال تبدیل کردیم. ثابت میشود که اوربیتالها به هنگام برهمکنش با یکدیگر، آزادند که شکل خود را تغییر دهند، اما تعداد آنها تغییر نخواهد کرد.
اما چگونه اروبیتال گمشده در مثال قبل را پیدا کنیم؟ برای پاسخ به این سوال باید به شاخصه موجی اوربیتالها رجوع کنیم. میدانیم که امواجی همچون صوت، نور یا حتی امواج دریا میتوانند با یکدیگر ترکیب شوند و برهمکنش انجام دهند. این کار از دو راه امکانپذیر است: میتوانند یکدیگر را تقویت کنند و موجی قویتر بسازند یا اینکه در اثر تداخل، یکدیگر را به طور جزئی تخریب کنند.
مشابه همین امر نیز زمانی اتفاق میافتد که «امواج ماده» (Matter Waves) متناظر با دو اوربیتال اتمی هیدروژن، با یکدیگر برهمکنش انجام میدهند. هر دو ترکیب همفاز و ناهمفاز در این شرایط اتفاق میافتند. برهمکنش همفاز، یک اوربیتال پیوندی را تشکیل میدهد که در مثال قبل در نظر گرفتیم. ترکیب دیگر، یا همان برهمکنش ناهمفاز، اوربیتال مولکولی را بدست میدهد که دارای بیشترین احتمال حضور الکترون در منطقه ضدپیوندی است. در نتیجه، اوربیتال دوم، موسوم به اوربیتال ضدپیوندی است.
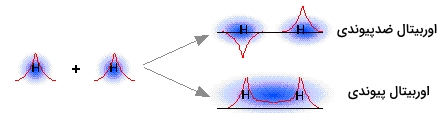
زمانی که دو تابع موج به صورت ناهمفاز با یکدیگر ترکیب شوند، مناطق با احتمال زیاد حضور الکترون، در یکدیگر ادغام نمیشوند. در حقیقت، رفتار اوربیتالها به گونهای است که گویی یکدیگر را دفع میکنند. توجه داشته باشید که فضایی بین دو هسته وجود دارد که احتمال یافتن الکترون در آن صفر است. به این منطقه، «سطح گرهای» (Nodal Surface) میگویند و مشخصهای از اوربیتال ضدپیوندی است. بوضوح میتوان دریافت، هر الکترونی که در اوربیتال ضدپیوندی حضور داشته باشد، توانایی شرکت در تشکیل پیوند را نخواهد داشت، در حقیقت، این الکترونها از تشکیل پیوند جلوگیری میکنند.
بنابراین، زمانی که دو اوربیتال از دو اتم مجزا با یکدیگر برهمکنش میکنند و هسته دو اتم را به طرف یکدیگر سوق میدهند، این دو اوربیتال اتمی، به یک جفت اوربیتال مولکولی تبدیل خواهند شد که یکی خاصیت پیوندی و دیگری خاصیت ضد پیوندی دارد. در بررسیهای پیشرفتهتر، میتوان نشان داد که چنین پدیدهای، نتیجه خاصیت موجی دو اوربیتال است.
اما چه اختلافی بین این دو نوع اوربیتال وجود دارد؟ به طور دقیقتر، کدامیک از اوربیتالها سبب میشوند تا الکترون، انرژی پتانسیل کمتری داشته باشد؟ انرژی پتانسیل در جایی کاهش پیدا میکند که در آن منطقه، بار مثبت بیشتری داشته باشیم. در یک مولکول دو اتمی ساده، منطقهای بین دو هسته چنین خاصیتی دارد و الکترون، همزمان به هر دو هسته نزدیک است. در نتیجه، اوربیتال پیوندی، پایینترین انرژی پتانسیل را دارد.
چگونگی رسم دیاگرام اوربیتال مولکولی
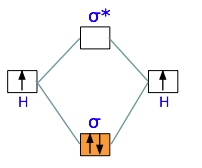
نموداری که در تصویر زیر مشاهده میکنید، به دیاگرام اوربیتال مولکولی موسوم و مربوط به یون دیهیدروژن $$H _ 2 ^ +$$ است. همانند اروبیتالهای اتمی، ابتدا اوربیتالهای مولکولی با انرژی کمتر پر میشوند. در نتیجه، تنها الکترونی که داریم، به اوربیتال پیوندی انتقال پیدا میکند و اوربیتال ضدپیوندی خالی میماند.
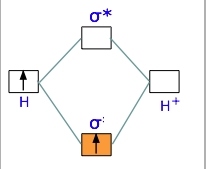
از آنجایی که هر اوربیتال در نهایت میتواند دو الکترون را در خود جای دهد، تنها نیمی از اوربیتال پیوندی در یون دیهیدروژن پر میشود. با این وجود، این الکترونِ تنها، برای پایین آوردن انرژی پتانسیل یک مول از جفتهسته هیدروژن با انرژی $$270 kJ$$ کفایت میکند. با وجود اینکه $$H _ 2 ^ +$$ از لحاظ انرژی، پایدار محسوب میشود اما مولکولی بسیار واکنشپذیر است به گونهای که با خود نیز وارد واکنش خواهد شد.
دیاگرام اوربیتال مولکولی دیهیدروژن
در حالت قبل دیدیم که تنها یک الکترون، میتواند موجب کاهش انرژی و تشکیل پیوند شود. حال اگر دو الکترون داشته باشیم، این روند چگونه خواهد بود؟ با ادغام دو هسته و دو الکترون، نمودار انرژی را به صورت زیر میتوان نشان داد:

از آنجایی که یک الکترون، انرژی را به میزان $$270 kJ/mol$$ کاهش داد، انتظار داریم که دو الکترون، دو برابر این مقدار، یعنی $$540 kJ/mol$$ کاهش انرژی ایجاد کند.
مرتبه پیوند
«مرتبه پیوند» (Bond Order)، به صورت اختلاف بین تعداد جفتالکترونهای اروبیتالهای پیوندی و ضدپیوندی تعریف میشود. هر مرتبه پیوند واحد را به صورت یک پیوند یگانه تعریف میکنند.
به صورت آزمایشگاهی نشان داده میشود که برای شکستن پیوندهای یک مول از $$H_2$$ به 452 کیلوژول انرژی نیاز داریم. دلیل عدم کاهش انرژی، به اندازه 540 کیلوژول را میتوان اینطور ذکر کرد که حضور دو الکترون در یک اوربیتال، دافعه ایجاد و به عنوان مانعی برای ایجاد پایداری عمل میکند. این اثر، دقیقا به هنگام مقایسه انرژیهای یونش اتمهای هیدروژن و هلیوم نیز در نظر گرفته میشود.
دیاگرام اوربیتال مولکولی دیهلیوم
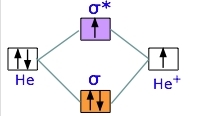
در این بخش، میخواهیم با دو الکترون کار کنیم. یون دیهلیوم، مولکولی با ۳ الکترون است. در حقیقت، اینجا، دو هسته هلیوم و سه الکترون داریم. این مولکول به اندازه دیهیدروژن پایدار نیست. انرژی مورد نیاز برای شکستن $$He _ 2^+$$ برابر با $$301 kJ/mol$$ است. دو الکترون، ابتدا در اوربیتال پیوندی پر میشوند اما الکترون سوم، به اوربیتال ناپیوندی تعلق دارد. همانطور که قبلا هم دیدیم، حضور این الکترون، دافعه ایجاد میکند و اثر اوربیتال پیوندی را کاهش میدهد.
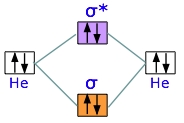
در مرحله بعد، دو اتم هلیوم با چهار الکترون را مورد بررسی قرار میدهیم. میتوان پیشبینی کرد که این مولکول، حالت پایدار ندارد چراکه دو الکترون در اوربیتال پیوندی و دو الکترون در اوربیتال ضدپیوندی داریم. در نتیجه، یکی از اوربیتالها به طور کامل دیگری را خنثی میکند. به طور آزمایشگاهی، انرژی پیوند برای دیهلیوم، مقدار $$0.084 kJ/mole$$ ذکر شده است که این مقدار انرژی، برای نگهداری دو اتم در کنار هم کفایت نمیکند. در نتیجه، دیهلیوم به سرعت، بعد از تشکیل شدن از بین میرود و نمیتوان آنرا مولکولی پایدار در شیمی قلمداد کرد.
دیاگرام اوربیتال مولکولی در مولکولهای دواتمی با اوربیتال s
مولکولهای سادهای که تا اینجا بررسی کردیم، اوربیتالهای مولکولی داشتند که از اوربیتال اتمی $$1s$$ مشتق شده بودند. در ادامه میخواهیم به اوربیتالهای اتمی بالاتری برسیم. در اینجا باید بگوییم که برای سادگی کار کافیست تا فقط اوربیتالهای لایه ظرفیت را در نظر بگیرید چراکه سایر اوربیتالهای اتمی، به دلیل میدان الکتریکی هستههای مجاور، به هنگام تشکیل پیوند، تغییری نمیکنند.
دیاگرام اوربیتال مولکولی دیلیتیوم
به طور مثال، اتم لیتیوم با آرایش $$1 s ^ 2 2 s ^ 1$$، با اتمی از جنس خود برای تشکیل $$Li_2$$ واکنش میدهد. با توجه به اینکه تنها دو الکترون داریم که آنها نیز اوربیتال پیوندی را پر میکنند، اوربیتال ضد پیوندی خالی و مولکول، پایدار خواهد بود.
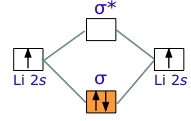
انرژی پیوند دیلیتیوم، مقداری برابر با $$110 kJ/mo$$ دارد. توجه داشته باشید که این مقدار، کمتر از نصف انرژی پیوند در دیهیدروژن است که در هر دو، دو الکترون در اوربیتال پیوندی داریم. دلیل این امر را باید در فاصله اوربیتال $$2s$$ از هسته جستجو کرد. این اوربیتال، فاصله بیشتری از هسته نسبت به اوربیتال $$1s$$، در اتم هیدروژن دارد. به عبارت دیگر، به عنوان یک قانون کلی، هر اندازه اتم والد بزرگتر باشد، مولکول دواتمی حاصل، پایداری کمتری خواهد داشت.
دیاگرام اوربیتال مولکولی لیتیوم هیدرید
مولکولهایی که تا الان بررسی کردیم، همگی «جورهسته» (Homonuclear) بودند. در اینجا میخواهیم سادهترین مولکول ناجورهسته را بررسی کنیم. لیتیوم هیدرید، مولکولی پایدار اما به شدت واکنشپذیر است. دیاگرام زیر، نحوه ارتباط اوربیتالهای اتمی و مولکولی را نشان میدهد. با کمی دقت متوجه خواهیم شد که اروبیتالهای اتمی، در اتمهای والد، انرژیهای متفاوتی دارند. بار بیشتر هسته، در اتم هلیوم، انرژی اوربیتال $$1s$$ آن را نسبت به اوربیتال $$1s$$ کاهش میدهد.
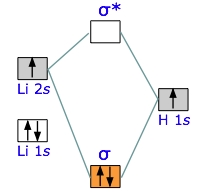
دو اوربیتال اتمی در اتم لیتیوم و یک اوربیتال در اتم هیدروژن داریم. اما اوربیتال اتمی هیدروژن، با کدامیک از اوربیتالهای لیتیوم، برهمکنش انجام میدهد. در دیاگرام بالا، اوربیتال $$1s$$ لیتیوم، کمترین انرژی را دارد. از آنجایی که این اوربیتال بسیار کوچک است و الکترونهای خود را با قدرت حفظ میکند، در پیوند شرکت نخواهد کرد. بنابراین، باید اوربیتال $$2s$$ در لیتیوم را بررسی کنیم.
در حقیقت، اوربیتال $$2s$$ از لیتیوم و $$1s$$ از هیدروژن، در تشکیل اوربیتالهای پیوندی و ضدپیوندی شرکت دارند. از مجموع چهار الکترون در لیتیوم و هیدروژن، دو الکترون در اوربیتال $$1s$$ لیتیوم باقی میماند و ۲ الکترون دیگر، در اوربیتال سیگما در پیوند کووالانسی $$Li-H$$ شرکت میکنند.
مولکول حاصل به میزان $$243 kJ/mol$$ پایدارتر از اتمهای والد خود است. همانطور که انتظار داریم، انرژی پیوند در یک مولکول ناجور هسته، بسیار به متوسط انرژی مولکول جورهسته متناظر با خود نزدیک است. البته برای متوسطگیری، بهتر است از متوسط هندسی انرژیهای پیوند استفاده کنیم.
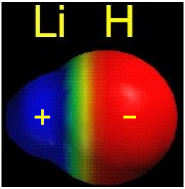
متوسط هندسی انرژیهای پیوند $$H_2$$ و $$Li_2$$ برابر با $$213 kJ/mol$$ است. اینطور که به نظر میرسد، مولکول لیتیوم هیدرید به میزان $$30 kJ/mol$$ پایدارتر از آن چیزی است که در نظر داشتیم. دلیل این حالت، اشتراک الکترونهای پیوند $$2\sigma$$ به صورت نامساوی بین دو هسته اتم ذکر میشود. در این حالت، اوربیتال اتمی، مقداری کشیدگی پیدا میکند به گونهای که جاذبه الکترونها بیشتر به سمت اتم هیدروژن باشد که در نهایت، «قطبیت پیوند» (Bond Polarity) را بوجود میآورد. دلیل این قطبیت، قدرت جاذبه الکترون هیدروژن به دلیل اندازه کوچک اتم آن است.
درصورتیکه الکترونها در مولکول لیتیوم هیدرید، به سرِ هیدروژنی نزدیکتر باشند، پایداری مولکول بیشتر خواهد بود. البته باید به این نکته اشاره کنیم که الکترونها به طور متوسط، نسبت به حالتی که در اوربیتال $$2s$$ اتم لیتیومِ تنها بودند، به هسته اتم لیتیوم نزدیکترند.
اوربیتالهای سیگما و پای
مولکولهایی که تا اینجا بررسی کردیم، همگی در مجموع، بیش از ۴ الکترون نداشتند. در نتیجه، مولکولهای ما تنها از اوربیتالهای نوع s تشکیل شدهاند. اگر بخواهیم نظریه اوربیتال مولکولی را برای اتمهای بزرگتر نیز اعمال کنیم، باید نگاهی عمیقتر به برهمکنش اوربیتالهای نوع p داشته باشیم. در این شرایط، اوربیتالهای نوع p نیز همانند قبل به اوربیتالهای پیوندی و ضدپیوندی تقسیم میشوند اما میزان تقسیم و انرژیهای مرتبط با آنها در اوربیتالهای مولکولی حاصل، تفاوت بسیاری با خود اوربیتالهای p دارد.
به خاطر دارید که برای هر عدد کوانتومی، تعداد ۳ اوربیتال نوع p وجود دارد. همچنین، میدانیم اوربیتالهای نوع p، شکلی کروی ندارند و به این دلیل که حالتی کشیده دارند، شامل جهتگیریهای مختلفی هستند. هر سه اوربیتال را در فضای کارتزین به سه شکل $$p_x$$، $$p_y$$ و $$p_z$$ نشان میدهند و اوربیتالها، در محور متناظر خود جهتگیری دارند.
در یک اتم تنها، از آنجایی که مختصاتی برای آن تعریف نمیشود، تمامی جهتها با یکدیگر همارز و موسوم به اوربیتال p هستند. اما در صورتیکه، اتمی در مجاورت اتمی دیگر باشد، میدان الکتریکی حاصل از آن اتم را به عنوان نقطه مرجع میشناسند که این نقطه، جهتگیریها را تعیین میکند. به طور معمول، خطی که از مراکز دو هسته عبور میکند را به عنوان محور $$x$$ در نظر میگیرند. دو محور $$y$$ و $$z$$ نیز به ترتیب در داخل صفحه و عمود بر صفحه قرار دارند.
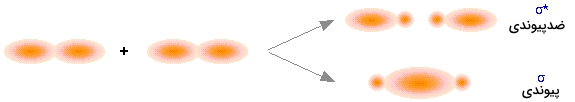
این نوع از جهتگیریها، دو دسته از اوربیتالهای مولکولی را پدید میآورند. تصویر بالا، نحوه برهمکنش دو اوربیتال $$p_x$$ را نشان میدهد. در بسیاری از حالات، اروبیتال مولکولی حاصل، شبیه آن چیزی است که در ترکیب اوربیتالهای s بدست میآوردیم. اوربیتال پیوندی، چگالی الکترونی زیادی در منطقه بین دو هسته دارد و متناظر با انرژی پتانسیل کمتر است.
در ترکیب ناهمفاز، بیشتر چگالی الکترون، در فضایی خارج از ناحیه بین هستهای قرار دارد و همانند قبل، صفحهای دقیقا در میان هسته و چگالی الکترون صفر وجود دارد که به آن اوربیتال ضد پیوندی میگویند. شکل این اوربیتال نیز بسیار به اوربیتالهای ضد پیوندی هیدروژن شبیه است. این نوع از اوربیتالهای اتمی، موسوم به اوربیتال «سیگما» $$\sigma$$ هستند.
اوربیتالهای سیگما، نسبت به خط تقارن مراکز هسته، به شکل استوانه متقارن دیده میشوند. این امر بدین معنی است در دو طرف این خط، چگالی الکترون در همه جهات به یک اندازه خواهد بود.
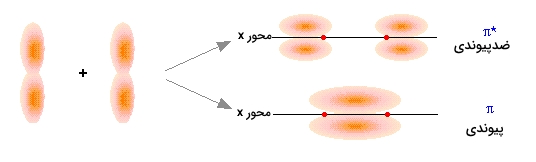
برخلاف اوربیتالهای سیگما، در اوربیتالهای «پای» $$(\pi)$$، این تقارن ممکن است در یک جهت وجود نداشته باشد و به عبارت دیگر، شکل تقارن اوربیتالهای پای، ساده نیست. این اختلاف در خواص هندسی اوربیتالهای سیگما و پای، موجب شده است تا اوربیتالهای سیگما، به اوربیتال پیوندی $$\sigma$$ و ضدپیوندی $$\sigma^ *$$ تقسیم شوند. همواره، اوربیتالهای ضدپیوندی $$\sigma^ *$$ انرژی بیشتری نسبت به اوربیتالهای سیگما دارند. بسته به نوع اتم، اوربیتال پیوندی سیگما میتواند، پایینتر یا بالاتر از اوربیتال پای باشد.
دیاگرام اوربیتال مولکولی در مولکولهای دواتمی با اوربیتالهای s و p
اگر اوربیتالهای $$2s$$ و $$2p$$ را با یکدیگر ترکیب کنیم، میتوانیم مرتبه پیوندی تمامی یونها و مولکولهای دواتمی موجود در ردیف اول جدول تناوبی را پیشبینی کنیم. همانطور که پیشتر هم ذکر شد، تنها نیاز داریم تا اوربیتالهای لایه ظرفیت اتمها را مورد بررسی قرار دهیم.
نمودار اوربیتال مولکولی دیکربن
کربن در لایه ظرفیت خود ۴ الکترون دارد. دو الکترون در $$2s$$ و دو الکترون در $$2p$$. برای دو اتم کربن، در نهایت هشت الکترون خواهیم داشت که در ۴ اوربیتال مولکولی قرار میگیرند. دو اوربیتال اول، اوربیتالهای پیوندی حاصل از $$2s$$ هستند. در نتیجه، ۴ الکترون اول، یکدیگر را خنثی میکنند و دخالتی در تشکیل پیوند ندارند. ۴ الکترون بعدی، در اوربیتالهای پای جای میگیرند و الکترونی برای اوربیتالهای ضد پیوندی باقی نمیماند. در نتیجه، میتوان تصور کرد که مولکول دیکربن، مولکولی پایدار است.
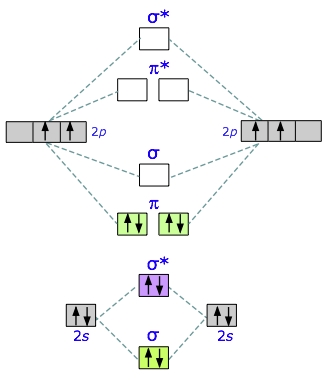
به کمک ساختار لوویس و پیوند کووالانسی به یاد دارید که یک جفتالکترون پیوندی را به عنوان پیوند یگانه در نظر میگرفتیم. در خصوص مولکول $$C_2$$، دو جفتالکترون در اوربیتالهای پیوندی پای داریم. در نتیجه، در اینجا یک پیوند دوگانه داریم. به عبارت سادهتر، تعداد پیوند یگانه، مرتبه پیوند را مشخص میکند و مرتبه پیوند در اینجا، ۲ است.
نمودار اوربیتال مولکولی دیاکسیژن
آرایش الکترونی مولکول $$O_2$$ را در لایه آخر به صورت زیر نشان میدهند:
$$1s^ 2 2s^ 2 2p^ 4$$
بنابراین، با توجه به اینکه در هر اتم اکسیژن، ۶ الکترون در لایه ظرفیت داریم، باید ۱۲ الکترون را در اوربیتالهای مولکولی پر کنیم. همانطور که در شکل پایین میبیند، در نهایت، دو الکترون در اوربیتالهای ضدپیوندی جای میگیرند. هرکدام از این الکترونها، یک اوربیتال $$\pi^*$$ را اختیار میکنند.
انرژی پیوند در مولکول اکسیژن، $$498 kJ/mol$$ و انرژی پیوند در مولکول $$N_2$$ برابر با 945 kJ/mol است زیرا در $$N_2$$ تنها یک الکترون در اوربیتال ضدپیوندی داریم.
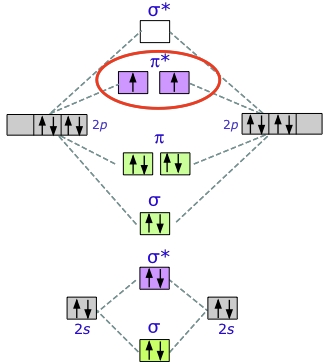
دو جفتالکترون ناپیوندی در مولکول دیاکسیژن، خاصیتی غیرمعمول و خاص به این ماده میدهند. مولکول اکسیژن «پارامغناطیس» (Paramagnetic) است. این خاصیت را میتوان با قرار دادن اکسیژن مایع بین دو قطب آهنربای دائمی نشان داد. جریان مایع در فضای بین دو قطب به دام میافتد و این فضا را پر میکند.

از آنجایی که مولکول اکسیژن دارای دو الکترون در اوربیتال ضدپیوندی است، میتوان باحذف یکی از این دو الکترون، پایداری آن را بیشتر کرد. با این کار، نسبت الکترونهای پیوندی به ضدپیوندی بیشتر میشود. به طور مشابه نیز، اضافه کردن الکترون، موجب تضعیف پیوند خواهد بود.
پیوندها در اوربیتالهای مولکولی
در این بخش قصد داریم تا در خصوص پیوند و مرتبه پیوند در اوربیتالهای مولکولی به بحث بپردازیم.
انحطاط اوربیتال
«انحطاط اوربیتالهای مولکولی» (Orbital Degeneracy) زمانی پیش میآید که انرژی اوربیتالها یکسان باشند. به طور مثال، در یک مولکول دواتمی جور هسته، که از ده عنصر اول ساخته شده باشد، اوربیتالهای مولکولی، از اوربیتالهای اتمی $$p_x$$ و $$p_y$$ مشتق شدهاند که هرکدام شامل اوربیتالهای پیوندی و ضدپیوندی هستند.
پیوند یونی
زمانی که اختلاف انرژی بین اروبیتالهای اتمی در دو اتم تقریبا زیاد باشد، یکی از اوربیتالها حالت پیوندی و دیگری به طور کامل ضدپیوندی خواهد بود. در این شرایط، یکی از الکترونها - یا بیشتر - از یک اتم به اتم دیگر منتقل میشود که چنین مفهومی را با نام پیوند یونی میشناسیم.
مرتبه پیوند
برای مشخصهسازی پیوندهای مولکولی، باید مرتبه پیوند را محاسبه کنیم. مرتبه پیوند عبارتست از نیمی از مجموع الکترونهای اوربیتالهای پیوندی منهای مجموع الکترونهای اوربیتالهای ضد پیوندی که با رابطه زیر تعریف میشود:
۲/(الکترونهای اوربیتال ضدپیوندی - الکترونهای اوربیتال پیوندی) = مرتبه پیوند
همانطور که دیدیم، در مولکولهای دواتمی، مرتبه پیوند، نوع پیوند اعم از یگانه، دوگانه یا سهگانه را مشخص میکند. برای مولکولهای بزرگتر، این تعریف قدری پیچیدهتر است و نمیتوان با تعداد پیوندها آن را توضیح داد. به طور مثال، در تصویر زیر، تصویر اوربیتال مولکولی متان آورده شده است:
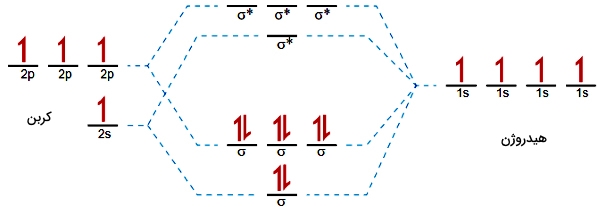
اوربیتالهای اتمی را در کربن و هیدروژن مشاهده میکنید. در اینجا، ۴ الکترون در اوربیتالهای $$1s$$ هیدروژن و ۴ الکترون در اوربیتالهای $$2s$$ و $$2p$$ کربن داریم. مولکول متان، چهار اوربیتال مولکولی $$\sigma$$ و چهار اوربیتال مولکولی $$\sigma ^ *$$ دارد و تمامی الکترونها در اوربیتالهای پیوندی دیده میشوند. در نتیجه، مرتبه پیوند در مولکول متان به صورت زیر محسابه میشوند:
$$\frac{1}{2} \times (8-0) = 4$$
این عدد نشاندهنده این نیست که ما یک پیوند چهارگانه بین کربن و هیدروژن داریم بلکه در مجموع، ۴ پیوند یگانه داریم. در اینجا میتوان این نکته را خاطرنشان کرد که نظریه اوربیتال مولکولی، کل یک مولکول را در بر میگیرد و شامل نوع پیوند بین دو اتم تنها نیست.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش مدلسازی انواع ساختار مولکولی با HyperChem (هایپرکم)
- پاد هیدروژن چیست؟ — به زبان ساده
- قالبزنی مولکولی — به زبان ساده
^^











سلام و تشکر از اموزش خوبتون
در مورد مولکول متان چرا برای اربیتال های p، پیوند رو سیگما در نظر میگیریم و پای حساب نمیشه
یه سوال ؟
دیاگرام اوربیتال مولکولی HF چجوریه؟
سلام و عرض خسته نباشید
من یک سوال درمورد اوربیتال ها داشتم که فکر کنم برای شما این سوال خیلی راحت باشه چون من هنوز به کلاس دهم نرسیدم ولی این سوال خیلی ذهنم رو درگیر کرده ، ممنون میشم پاسخ بدید
سوالم این هست که در ترکیب کربن مونوکسید که پیوند کووالانسی داره، ما هر کار بکنیم پایدار نمیشن مگر بینشون پیوند داتیو هم برقرار شه که باید اوربیتال خالی هم باشه. حالا از کجا متوجه بشیم که اتم ها چند اوربیتال خالی دارند؟!
سلام
شما المپیادی هستید؟
با سلام؛
اینکه هریک از اتمها چه تعداد اوربیتال خالی میتوانند داشته باشید به آرایش الکترونی آنها مرتبط است که با یادگیری آرایش الکترونی، نحوه تشکیل این پیوند نیز مشخص خواهد شد. با این وجود، پیشنهاد میکنیم برای اطلاعات بیشتر، مطالب زیر را مطالعه کنید:
اوربیتال و آرایش الکترونی — به زبان ساده (+ دانلود فیلم آموزش گام به گام)
ساختار لوویس و نحوه رسم آن — به زبان ساده (+ دانلود فیلم آموزش گام به گام)
پیوند داتیو — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس
استاد اگ جواب منو بدید خیلی خیلی ممنون میشم
سلام میشع دیاگرام مولکولی نیترید بور رو رسم کنید؟ خیلی ممنون میشم
یه سوال ؟
اوربیتال مولکولی نیتروژن و کربونیل عین همه… فقط در Co بخاطر الکترونگاتیوی متفاوت ،سطح انرژی O پایینتره…
سوال من اینه ک ؛ نیتروژن پای اکسپتور ضعیفتریه نسبت به کربونیل ؟ یا قویتر ؟
سطح انرژی homo و lumo به صورت تجربی چجوری بدست میاد ؟
باسلام
چرا اوربیتال 2s کربن یک الکترون دارد و یکیش رفته داخل p
با سلام؛
هر دو اوربیتالهای HOMO و پای LUMO در CO، در رابطه با اتم کربن به صورت قطییده هستند و بنابراین، همپوشانی اوربیتالهای فلزی بهتر صورت میگیرد و پیوند CO قویتر از N2 و لیگاندی معمولتر نسبت به نیتروژن است. همچنین، مقایسهای بین این اوربیتالهای مولکولی، به خوبی، دهنده سیگما و پذیرنده پای را نشان میدهد و در CO، پای پذیرنده به صورت 2pi و در نیتروژن به صورت $$1 \pi _u (\pi^ *)$$ است.
با تشکر از همراهی شما با مجله فرادرس
سلام وقتتون بخیر میشه از روی درجه پیوند پایداری دو تا مولکول را مقایسه کرد؟
با سلام؛
با استفاده از مرتبه پیوند میتوان پایداری یک مولکول را مورد بررسی قرار داد و آنرا با مولکولی دیگر مقایسه کرد که پیشنهاد میکنیم برای آشنایی با مثالهای بیشتر، مطلب «طول پیوند و مرتبه پیوند در شیمی — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
درود به شما درس شیمی فزیکی آلی پیشرفته اگر دارید من بیننده هستم
با سلام؛
در رابطه با شیمی فیزیک پیشنهاد میکنیم دوره «آموزش شیمی فیزیک» را مشاهده کنید.
با تشکر از همراهی شما با مجله فرادرس
متن تان خیلی عالی وپر محتوا بوده واقعا فرادرس است اگر ممکن باشد موضوعات را کمی ساده تر ارائیه کنید بهتر خواهد بود، سپاسگذارم از زحمات تان
با سلام
ضمن تشکر بابت مطالب مفیدتون
میخواستم بپرسم منظور از این جمله که بر حسب نوع اتم اوربیتال سیگما میتونه پایین تر یا بالاتر از پای باشه، چیه؟
با سلام؛
از شما بابت مطالعه مطلب سپاسگزاریم. کافی است به دیاگرام رسم شده در مثالها توجه کنید. در این مثالها، بسته به انرژی، اوربیتال سیگما بالاتر یا پایینتر از پای قرار دارد.
با تشکر
امکانش هست دیاگرام اوربیتال مولکولی آمونیاک رو توضیح بدین؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. آمونیاک ۸ الکترون ظرفیت شامل یک جفت الکترون ناپیوندی بر روی نیتروژن و ۳ پیوند سیگما نیتروژن-هیدروژن دارد. دیاگرام اوربیتال مولکولی آمونیاک در این لینک قرار داده شده است.
با تشکر
برای تحقیقم اومدم، عالی بود. تشکر فراوان