الکل ها — از صفر تا صد

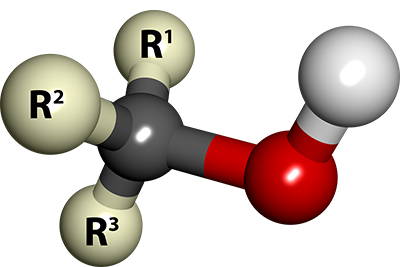
الکل یک ماده آلی شامل گروه عاملی OH متصل به کربن با فرمول عمومی $$R - OH$$ است. الکلها بیشترین ترکیبات آلی را تشکیل میدهند. در ساخت عطرها و سنتز بسیاری از ترکیبات بکار میروند. دو مورد از مهمترین الکلها در جهان، متانول و اتانول هستند. از اتانول در تهیه لوازم آرایشی، داروسازی و سوختها استفاده میشود. متانول به عنوان ماده اولیه در تهیه فرمالدهیدها و رزینها کاربرد دارد. همچنین از این الکل در سوختها، ضدیخ و تمیز کردن فلزات بهره میبرند. تقطیر الکل در حدود 2000 سال قبل از میلاد مسیح در هند صورت میگرفت اما زکریای رازی در جهان به عنوان کاشف اتانول شناخته شده است.
کاربردها
الکلها از گذشته کاربردهای فراوانی داشتهاند که در زیر به برخی از آنها اشاره میکنیم:
- متانول: برای تولید فرمالدهید و مکملهای سوخت
- اتانول: در مکملهای سوخت و استریلیزه کردن وسایل بیمارستانی
- ۱-پروپانول، ۱-بوتانول و ایزو بوتیل: برای استفاده به عنوان حلال و ماده اولیه حلالها
- الکلهای C_6 تا C-11: به منظور افزایش خاصیت پلاستیکی یا کاهش ویسکوزیته مواد
- الکلهای چرب: به عنوان ماده اولیه مواد شوینده
نامگذاری الکلها
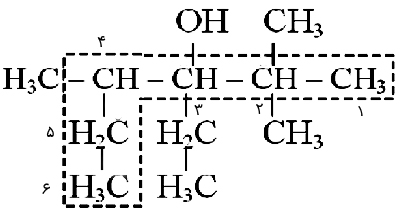
در نامگذاری الکلها به روش آیوپاک، پسوند «-ول» (ol-) به انتهای نام آن اضافه میشود. به طور مثال اتانول، از آلکان با شاخه اصلی دو کربنه یعنی اتان گرفته شده است.
لازم است که در ابتدا محل، تعداد و نام شاخه فرعی سپس محل گروه متصل به OH و در نهایت نام شاخه اصلی با پسوند -ول بیان شود، مانند: ۳-اتیل ۲و۲و۴ تریمتیل ۳-هگزانول.
نوع دیگر نامگذاری الکلها اضافه کردن نام الکل به گروه آلکیل متناظر با آن است. مانند: متیل الکل، اتیل الکل یا ایزوپروپیل الکل. الکل ها همچنین در دستهبندی دیگری به الکلهای نوع اول، دوم و سوم تقسیم میشوند.
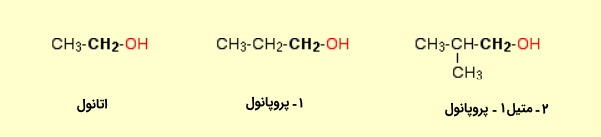
الکل نوع اول
اگر به کربن متصل به گروه $$OH$$، تنها یک گروه آلکیل متصل باشد، به آن الکل نوع اول یا الکل نوع ۱ میگویند. نمونههایی از الکل نوع اول در زیر آورده شده است:
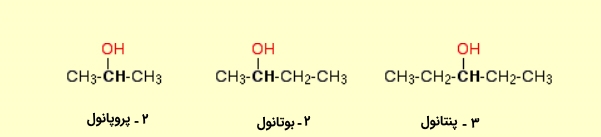
الکل نوع دوم
در صورتی که دو گروه آلکیل به اتم متصل به گروه هیدروکسیل وصل شده باشند، به آن الکل نوع دوم اطلاق میشود که نمونههایی از آن در زیر آورده شده است:
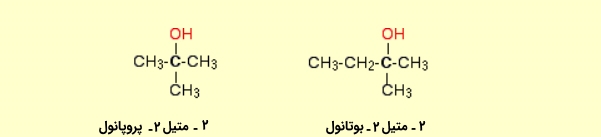
الکل نوع سوم
با توجه به ترتیب ذکر شده، اگر گروههای متصل به کربن شامل سه گروه باشند، الکل مورد نظر، نوع سوم است که نمونههایی از آن را در تصویر زیر میبینید:
خواص فیزیکی الکلها
به طور کلی، گروه هیدروکسیل سبب قطبی شدن الکلها میشود. این گروهها با خود و ترکیبات دیگر پیوندهای هیدروژنی تشکیل میدهد. با توجه به حضور گروه OH، این ترکیبات نسبت به هیدروکربنها حلالپذیری بیشتری در آب دارند. متانول، اتانول و پروپانول در آب امتزاجپذیر هستند. در این میان بوتانول با چهار اتم کربن در زنجیر کربنی، تقریبا در آب امتزاجپذیر است.
با توجه به پیوند هیدروژنی الکلها، این ترکیبات نقطه جوش بالاتری نسبت به هیدروکربنها و اِترها دارند. به عنوان مثال نقطه جوش اتانول 78/29 درجه سانتیگراد، اما نقطه جوش هگزان 69 درجه سانتیگراد است.
تاثیر نیروهای واندروالس بر نقطه جوش
الکلها علاوه بر نیروی پیوند هیدروژنی، در معرض نیروهای بین مولکولی دیگر همانند واندروالس و برهمکنش دوقطبی - دوقطبی نیز هستند. پیوندهای هیدروژنی و برهمکنش دوقطبی - دوقطبی برای همه الکلها یکسان است، اما نیروهای واندروالس با افزایش اندازه الکلها، افزایش پیدا میکنند. این نیروها با افزایش طول مولکول و به تبع آن افزایش تعداد الکترونها قویتر میشوند. به همین دلیل با افزایش تعداد اتم کربن، نقطه جوش افزایش پیدا میکند.
حلالپذیری الکلها در آب
الکلهای کوچک در آب حلالپذیری بالایی دارند و با هر نسبت در آب حل میشوند. با افزایش طول زنجیر هیدروکربنی، حلالپذیری این ماده در آب کاهش مییابد. هنگامی که یک الکل شامل بیش از ۴ اتم کربن باشد، حل نشدن الکل در آب کاملا محسوس است و در لوله آزمایش، این دو محلول با یک مرز از یکدیگر جدا میشوند.
به طور مثال، اتانول را به عنوان یک الکل کوچک در نظر بگیرید. در آب و اتانول، نیروی بین مولکولی غالب، پیوند هیدروژنی است. برای مخلوط کردن این دو ماده، پیوندهای هیدروژنی بین آب و اتانول باید شکسته شوند که برای این کار، هر دو به انرژی نیاز دارند. با مخلوط شدن این دو ماده، پیوندهای هیدروژنی جدیدی بین مولکولهای آب و اتانول تشکیل میشوند.

انرژی آزاد شده به هنگام تشکیل پیوندهای جدید هیدروژنی تقریبا با انرژی مورد نیاز برای شکستن پیوندهای هیدروژنی در آب و الکل برابر است. علاوه بر این، شاهد افزایش بینظمی در سیستم و به تبع آن افزایش آنتروپی خواهیم بود. افزایش آنتروپی نیز به عنوان یک عامل در انجام پذیر بودن یک واکنش میتواند در نظر گرفته شود.
اما در خصوص الکل با تعداد کربن بیشتر، کافی است یک الکل با پنج اتم کربن را در نظر بگیرید. با حل شدن در آب، زنجیرههای کربنی بین مولکولهای آب قرار میگیرند و سبب شکستن پیوندهای هیدروژنی آب میشوند.
سرِ $$- O H$$ مولکولهای الکل با مولکولهای آب پیوند هیدروژنی تشکیل میدهند اما زنجیره کربنی توانایی تشکیل پیوند هیدروژنی را ندارد. این عمل بدین معنی است که بسیاری از پیوندهای هیدروژنی شکسته شده، با پیوندهای جدیدتر جایگزین نخواهند شد و به جای آن نیروی واندروالس میان زنجیر کربن و آب برقرار میشود. این نیروها قدرت لازم برای جبران انرژی شکستن پیوندهای هیدروژنی را ندارند. حتی با افزایش بی نظمی سیستم، امکان ادامه فرآیند ممکن نیست. هرقدر تعداد اتم کربن در الکل افزایش پیدا کند، بیشتر شاهد این شرایط خواهیم بود و به همین دلیل با افزایش تعداد اتم کربن، حلالپذیری الکل در آب کاهش پیدا میکند.
الکلها در طبیعت
الکلهای ساده به وفور در طبیعت یافت میشوند. در این میان، اتانول به این دلیل که محصول حاصل از تخمیر است، اهمیت بیشتری دارد. انواع دیگر الکلهای ساده دارای مقدار کمتری در طبیعت هستند. الکلها با ساختار پیچیدهتر در شکر، آمینواسیدها و اسیدهای چرب وجود دارند.

منابع صنعتی الکلها
دو راه کلی برای دسترسی به الکلهای ساده در صنعت وجود دارد: با هیدراته کردن آلکنهایی که از طریق کراکینگ نفت خام بدست آمدهاند و از طریق تخمیر کربوهیدراتها. البته آلکنها به سادگی از طریق روش آبدهی یا اضافه کردن سولفوریک اسید پس از هیدرولیز، به الکل تبدیل میشوند که به این نوع روش هیدراته کردن الکترون دوست نیز میگویند.
الکلها بخش مهمی از شیمی پایه و عمومی را تشکیل میدهند. بنابراین، درک آنها از اهمیت بالایی برخوردار است. در نتیجه، برای آشنایی بهتر با این مبحث میتوانید از مجموعه آموزش شیمی دانشگاهی (عمومی، آلی و تجزیه) فرادرس استفاده کنید.
تهیه الکل ها
یکی از روشهای تهیه الکلها استفاده از فرآیند زیگلر است. این فرآیند در نهایت سبب تشکیل الکلها با ساختار خطی میشود. در رابطه زیر، سنتز ۱-اوکتانول نمایش داده شده است:
$$\$mathrm{Al}\left(\mathrm{C}_{2} \mathrm{H}_{5}\right)_{3}+9 \mathrm{C}_{2} \mathrm{H}_{4} \rightarrow \mathrm{Al}\left(\mathrm{C}_{8} \mathrm{H}_{17}\right)_{3}$$$
$$\$mathrm{Al}\left(\mathrm{C}_{8} \mathrm{H}_{17}\right)_{3}+3 \mathrm{O}+3 \mathrm{H}_{2} \mathrm{O} \rightarrow 3 \mathrm{HOC}_{8} \mathrm{H}_{17}+mathrm{Al}(\mathrm{OH})_{3}$$$
رابطه بالا سبب تولید الکلهای مختلفی میشود که جداسازی آنها از طریق تقطیر امکانپذیر است. الکلهای پیچیدهتر با استفاده از «هیدروفرمیلاسیون» (Hydroformylation) آلکنها بعد از یک واکنش هیدروژنه تولید میشوند که نمونهای از آن در زیر آورده شده است:
$$\$mathrm{RCH}=\mathrm{CH}_{2}+mathrm{H}_{2}+mathrm{CO} \rightarrow \mathrm{RCH}_{2} \mathrm{CH}_{2} \mathrm{CHO}$$$
$$\$mathrm{RCH}_{2} \mathrm{CH}_{2} \mathrm{CHO}+3 \mathrm{H}_{2} \rightarrow \mathrm{RCH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{OH}$$$
این نوع از فرآیندها اسیدهای چرب تولید میکنند که در تهیه مواد شوینده کاربرد دارند.

واکنشهای هیدراته
همانطور که اشاره شد، یکی از روشهای تولید الکلها، آبدهی (هیدراته کردن) آلکنها است. اتانول، ایزو پروپانول، ۲-بوتانول و تِرت-بوتانول، با این روش تولید میشوند. واکنشهای آبدهی به دو صورت مستقیم و غیر مستقیم قابل اجرا هستند. در روش مستقیم، با استفاده از کاتالیزورهای اسیدی، از تشکیل محصولات واسطه جلوگیری میکنند. در روش غیر مستقیم از تبدیل آلکن به یک استر بهره میگیرند.
تولید بیولوژیکی
بر اثر هیدرولیز نشاسته، قند تولید میشود. با تخمیر گلوکز موجود در قند در دمای کمتر از 37 درجه، اتانول بدست میآید. تبدیل ساکاروز به گلوکز و فروکتوز از طریق آنزیم اینورتاز، نیاز به گلوکز برای فرآیند ذکر شده را تامین میکند. در ادامه، به کمک آنزیم «زیماز» (Zymase)، گلوکز تولیدی به اتانول و دیاکسید کربن تبدیل میشود.
باکتریهای بیهوازی در بدن از تخمیر به عنوان سوخت و ساز استفاده میکنند که حاصل آن تولید اتانول است. در نتیجه، بدن انسان حاوی مقادیری الکل تولیدی از طریق این باکتریها است.
واکنشهای جانشینی
آلکیل هالیدهای نوع اول با سدیم هیدروکسید یا پتاسیم هیدروکسید وارد نوعی از واکنش جانشینی میشوند که حاصل آن تولید الکلهای نوع اول است.
کاهش آلدهیدها و کتونها
آلدهیدها و کتونها از طریق واکنشهای کاهشی به الکل تبدیل میشوند. نمونهای از این فرآیندها، واکنش کاهشی «میروین-پاندورف-ورلی» ( Meerwein-Ponndorf-Verley) و تولید الکل است:
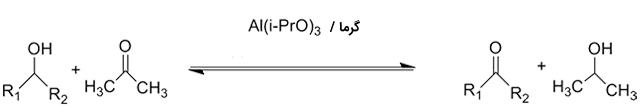
طرز تهیه آزمایشگاهی الکلها
به طور معمول با ۵ روش، الکلها در آزمایشگاه تهیه میشوند:
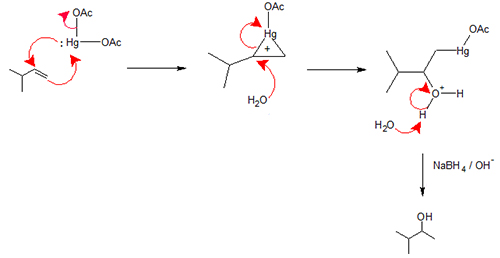
اکسی مِرکوراسیون - دِمرکوراسیون
این روش شامل یک واکنش الکترون دوست و تبدیل یک آلکن به الکل است.
هیدروبوراسیون - اکسیداسیون
این روش شامل یک واکنش هیدراته شدن دو مرحلهای و تبدیل یک آلکن به الکل است.
سنتز گرینیارد
واکنش ماده گرینیارد، مادهای با فرمول عمومی $$(R-Mg-X)$$ است که با اکسیژن تشکیل مینزیم اورگانوپراکسید میدهد. هیدرولیز (آبکافت) این ماده، هیدروپراکسید یا الکل میدهد:
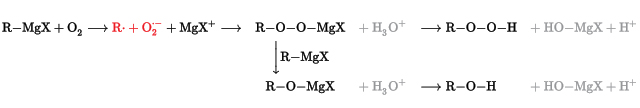
هیدرولیز آلکیل هالیدها
آلکیلهالیدها در یک واکنش ساده «جانشینی هسته دوست» (Nucleophilic Substitution)، در حضور آب یا هیدروکسید، به الکل تبدیل میشوند. در تصویر زیر، $$X$$ یک هالوژن است:
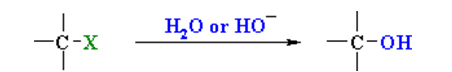
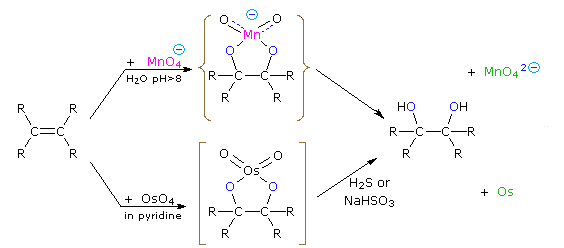
هیدروکسیلدار کردن آلکنها
واکنش مربوطه به همراه پرمنگنات و «اوسمیوم تتراکسید» (Osmium Tetroxide) در تصویر زیر آورده شده است:
واکنشها
در زیر، واکنشهایی که الکلها در آن شرکت میکنند به طور خلاصه آورده شده است.
واکنش در نقش اسید و باز
الکلها با داشتن $$pK_a$$ در حدود 16-19، به طور کلی اسیدهایی ضعیف هستند و در واکنش با بازهای قوی مانند «سدیم هیدرید» $$(NaH)$$، نمکهایی موسوم به آلکوکسید با فرمول عمومی $$R O ^- M ^ +$$ تشکیل میدهند.
$$\$2 \mathrm{R}-mathrm{OH}+2 \mathrm{NaH} \rightarrow 2 \mathrm{R}-mathrm{O}^{-} \mathrm{Na}^{+}+2 \mathrm{H}_{2}$$$
واکنشهای جانشینی الکترون دوست
اگر به گروه $$OH$$ در الکلها یک پروتون (اسید) بدهیم و آن را به $$R - O H _2 ^ {+}
$$ تبدیل کنیم، در حقیقت گروه $$OH$$ را که جداسازی آن از مولکول دشوار است، به گروهی مانند آب تبدیل کردهایم تا جداسازی آن در واکنشهای «جانشینی الکترون دوست» (Nucleophilic Substitution) سادهتر انجام شود. به طور مثال، الکلهای نوع سوم در واکنش با هیدروکلیریک اسید، آلکلیل هالید نوع سوم تولید میکنند. در این واکنش، گروه هیدروکسیل با یک واکنش جانشینی، با اتم کلر جایگزین میشود. برای واکنش الکلهای نوع اول یا دوم با هیدروکلریک اسید، به یک ماده فعالساز همچون «زینک کلرید» $$(Z n Cl _ 2)$$ نیاز داریم. همچنین در حضور «تیونیل کلرید» $$(S O Cl _ 2)$$، این تبدیل به طور مستقیم انجام خواهد شد.
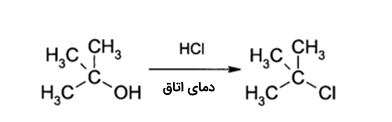
الکل ها با استفاده از هیدروبرمیک اسید، یا «فسفر تری برمید» $$(P Br _3)$$ به آلکیل برمید تبدیل میشوند:
$$\$3 \mathrm{R}-mathrm{OH}+mathrm{PBr}_{3} \rightarrow 3 \mathrm{RBr}+mathrm{H}_{3} \mathrm{PO}_{3}$$$
دهیدراته کردن
الکلها در حضور اسیدها، خاصیتی بازی از خود نشان میدهند و همانطور که پیشتر نیز بیان شد، در واکنشهای «آبگیری از الکلها» (Alcohol Dehydration)، به یک آلکن تبدیل میشوند. در زیر، واکنش دهیدراته شدن اتانول در حضور یک اسید - به عنوان کاتالیزور - برای تولید اتیلن آمده است:

استری کردن
الکل و کربوکسیلیک اسید در واکنشهایی همچون واکنش «استری کردن فیشر» (Fisher Esterification) شرکت میکنند. این واکنشها به طور معمول به یک کاتالیزور، مانند سولفوریک اسید غلیظ نیاز دارند:
$$\$mathrm{R}-mathrm{OH}+mathrm{R}^{\prime}-mathrm{CO}_{2} \mathrm{H} \rightarrow \mathrm{R}^{\prime}-mathrm{CO}_{2} \mathrm{R}+mathrm{H}_{2} \mathrm{O}$$$
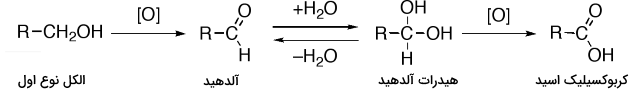
اکسیداسیون
الکل نوع اول با فرمول $$R - C H _2 O H $$ میتواند از طریق اکسایش به آلدهیدها $$R - C H O$$ یا کربوکسیلیک اسیدها $$R - C O _2 H$$ تبدیل شود. الکل نوع دوم در اثر اکسایش، تولید کتون میکند و الکلهای نوع سوم در برابر اکسید شدن مقاوم هستند.
در زیر، اکسیداسیون الکل نوع اول و تبدیل آن به کربوکسیلیک اسید بوسیله آلدهیدها و هیدراتهای آلدهید آورده شده است:
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی آلی ۱
- عدد اکسایش — به زبان ساده
- واکنش اسید و باز — از صفر تا صد
^^











سلام وقتتون بخیر
یک سوال داشتم ممنون میشم پاسخ بدید
اگر الکل 70 درصد که ماده تلخ کننده هم در اون هست در مجاورت مایع لباسشویی قرار بگیره
ا واکنش نشون میده؟ یا موردی نداره؟ روی جایی که مایع لباسشویی بود الکل اسپری کردم
ممنون میشم راهنمایی کنید 🙏🏼
سلام
به خاطر مطالب عالی مجله فرادر اول از همه باید یه خسته نباشید به همه عواملتون بگم چون انقدر خوبه که کار چندین منبع رد یک جا انجام میده ، خدا قوت
و این که . چرا مثل الکان و الکن و الکین که من توی مجله فرادرس مطالعه کردم، همشون ترتیب اعضا داخل مقالشون نوشته شده بود . چرا ترتیب اعضای الکل رو ننوشتید؟
با سلام؛
خوشحالیم که مطالعه مطلب برای شما مفید بوده است. اگر منظور شما از اعضا، انواع الکلها باشد، این اعضا به صورت الکل نوع اول تا سوم در داخل متن آورده شدهاند.
با تشکر از همراهی شما با مجله فرادرس
با سلام و احترام ممنون از مطالب بسیار خوبتون عذرخواهی میکنم ممکنه رفرنس اصلی این مطلب رو برای بنده ارسال کنید میخواستم برای یک مقاله از این مطلب استفاده کنم
سلام، وقت شما بخیر؛
منابع کلیه مطالب مجله فرادرس در انتهای آنها و بعد از بخش معرفی مطالب و آموزشهای مرتبط ذکر شده است.
از اینکه با مجله فرادرس همراه هستید از شما بسیار سپاسگزاریم.
سلام
میشه واکنش سوختن الکل های نوع اول را با فرمول بگید؟
سپاس
با سلام؛
به طور کلی در اثر واکنش سوختن کامل هیدروکربنها، گاز دیاکسید کربن و بخار آب تولید میشود. برای آشنایی بیشتر پیشنهاد میکنیم مطلب «فرآیند احتراق یا سوختن — از صفر تا صد (+ دانلود فیلم آموزش گام به گام)» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سوختن الکل ها واکنشش چه شکلیه؟؟
سلام.
لطف میکنید فرمول عمومی الکل سه عاملی رو بگین؟
ممنون میشم؛
سلام و روز شما بهخیر؛
نمیتوان برای الکلهای سه عاملی فرمولی عمومی بیان کرد که تمامی ترکیبهای این خانواده را پوشش دهد. الکلهای سه عاملی با یکدیگر یک نقطه اشتراک دارند و آن داشتن سه گروه عاملی هیدروکسیل $$(OH)$$ است. باقی ساختار این ترکیبهای میتواند بسیار متفاوت بسته به تعداد اتمهای کربن و دیگر عنصرها، بسیار متفاوت باشد.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
با سلام؛
به طور کلی، بر اثر سوختن کامل هیدروکربنها و مولکولهای آلی، دیاکسید کربن و بخار آب تولید میشود. پیشنهاد میکنیم برای اطلاعات بیشتر، مطلب «فرآیند احتراق یا سوختن — از صفر تا صد (+ دانلود فیلم آموزش گام به گام)» را مطالعه کنید.
با تشکر
سلام.
میخواستم بپرسم (( الکل دنات ))
نوعی الکل محسوب می شود؟
یعنی ترکیبات الکل در آن هست؟
یا اینکه ماده ی کاملا مجزا از الکل هست؟
واینکه دنات الکل مثل بنزیل الکل درطبیعت وجود داردیاخیر؟
سلام
ممنون از مباحث مطرح شده.
یه سوال داشتم خدمتتون و اون اینکه اگه در ظرف الکل باز بمونه در چه مدت زمان خاصیت الکل از دست میره و دیگه اون ۷۰ درصد رو برای ویروس کشی نداره؟
با سلام؛
از شما به دلیل مطالعه این مطلب سپاسگزاریم.
«الکل دنات» (Denatured Alcohol) در تعریف کلی، به الکل اتانولی میگویند که به کمک مواد افزودنی، خاصیتی سمی و تلخمزه پیدا کرده است. از مواد افزودنی مختلفی در تهیه این الکل بهره میگیرند تا نتوان از طریق تقطیر، به الکل اولیه دست پیدا کرد. روش تهیه آن این به این صورت است که در هر ۹۰ قسمت حجمی از الکل، باید ۹/۵ قسمت حجمی متانول و ۰/۵ قسمت پیریدین اضافه شود. به مخلوط حاصل، با غلظتی معین، نفتا اضافه میشود و در نهایت، برای مشخص شدن خاصیت سمی آن، از رنگ (متیل بنفش) بهره میگیرند.
با تشکر
سلام .
آیا الکل دنات نوعی الکل محسوب میشود وترکیبات الکل در آن هست؟و آیا الکل دنات مثل بنزیل الکل درطبیعت وجود دارد؟
سلام ممنون از مطالب خوبتون
میخواستم بدونم در الکل های چند عاملی مثلاً گلیسیرین که سه عامل دارد از چه روشی میتوان دانست که این الکل الکل نوع چندم است؟؟؟ منظورم اینه که کدوم کربن رو باید مد نظر دونست؟؟؟ ممنون میشم پاسخ دهید
با سلام؛
ترکیباتی که بیش از یک گروه هیدروکسیل دارند، با استفاده از پسوند «دیاول» (diol) و «تریاول» (triol) نامگذاری میشوند. اگر گروههای هیدروکسیل بر روی کربنهای مجاور قرار داشته باشند، به آنها «گلایکول» (glycol) میگویند. اگر گروه هیدروکسیل بر روی همان کربن قرار داشته باشد به آن «گم دیول» (gem diol) میگویند. در حقیقت، نام آلکان والد به همراه واژه دیاول» اضافه میشود. بنابراین، مشتقات آلکان که دو گروه هیدروکسیل داشته باشند به اتان+دیاول تبدیل میشوند و در ادامه، شماره گروههای هیدروکسیل ذکر میشود. به طور مثال میتوان ۱و۲-اتاندیول (اتیلن گلایکول) را نام برد.
با تشکر از همراهی شما با مجله فرادرس