اصل آفبا – به زبان ساده
اصل آفبا به نحوه پر شدن اوربیتالهای اتمی یک اتم توسط الکترونها در حالت پایه میپردازد. اصل آفبا بیان میکند که الکترونها با ترتیب افزایش سطح انرژی اوربیتالهای اتمی، آنها را پر میکنند. بر اساس این اصل، اوربیتالهای اتمی با انرژی کمتر، پیش از اوربیتالهای با سطوح انرژی بالاتر، توسط الکترونها پر میشوند.
اصل آفبا چیست؟
کلمه «آفبا» (Aufbau)، ریشهای یونانی دارد و میتوان آنرا به معنای «بنا کردن» (Construct) دانست به همین دلیل، در برخی از متون با نام «اصل بناگذاری آفبا» (Building-Up Principle) از آن یاد میشود.
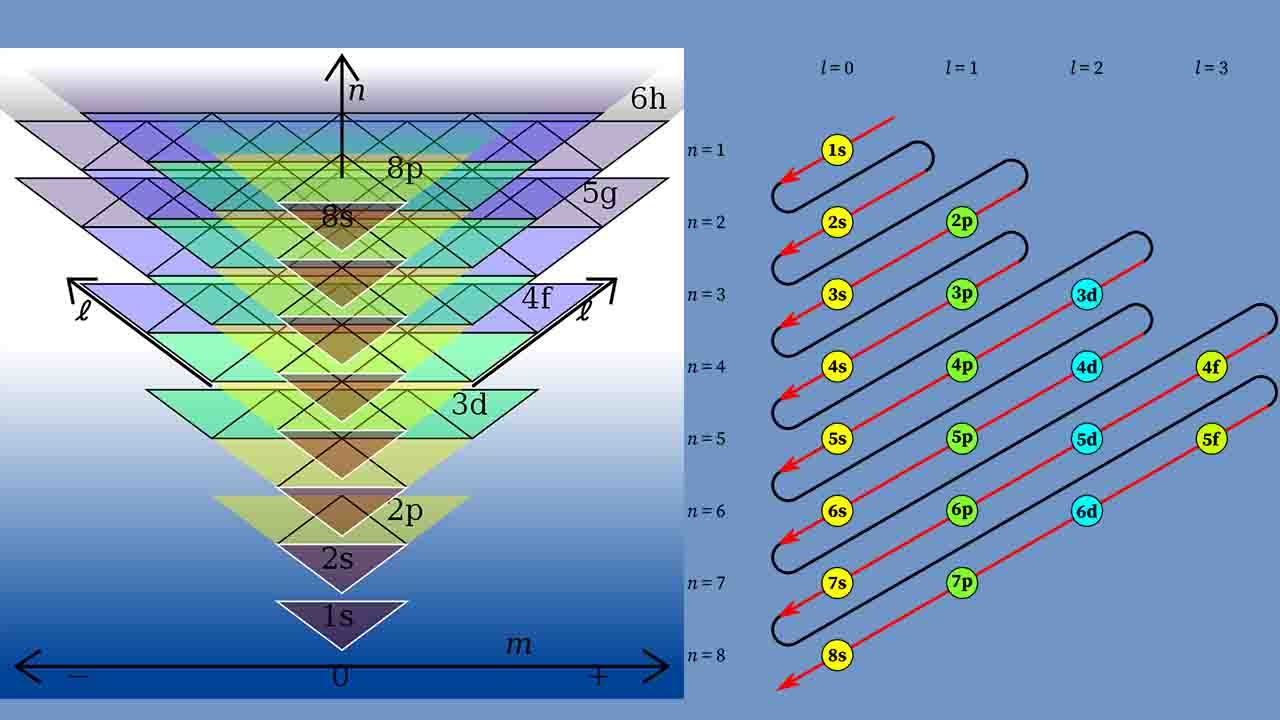
تصویر زیر نشان دهنده نحوه پر شدن اوربیتالها بر اساس اصل آفباست که در این تصویر، «n» بیانگر عدد کوانتومی اصلی و «l»، عدد کوانتومی فرعی است.
از اصل آفبا میتوان بمنظور فهم مکان الکترونها و انرژی متناظر با آنها در یک اتم استفاده کرد. به طور مثال، کربن، ۶ الکترون دارد و آرایش الکترونی آن به صورت زیر است:
$$1 s ^ 2 2s ^ 2 2 p^2$$
باید به یاد داشته باشیم که بر اساس اصل طرد پائولی، هر اوربیتال میتواند در نهایت ۲ الکترون را در خود جای دهد. همچنین، نحوه قرارگیری الکترونها در اوربیتال باید بر اساس «قواعد هوند» (Hund's Rule) باشد به این معنی که هر اوربیتال در زیرلایهای مشخص، ابتدا توسط یک الکترون پر میشود و بعد از پرشدن تمام اوربیتالهای یک زیرلایه (اوربیتال فرعی) با ۱ الکترون، الکترون دوم، اوربیتال را پر میکند.
تاریخچه اصل بناگذاری آفبا
دانشمندان مختلفی برای توسعه این اصل تلاش کردهاند. ترتیب اوربیتالها در مدلهای قدیمی مکانیک کوانتوم دیده شده که توسط «نیلز بور» (Niels Bohr) در اوایل دهه 1920 ارائه شده است. در پایان این دهه، «شارل ژانت» (Charles Janet)، مهندس فرانسوی، شکل دیگری از جدول تناوبی موسوم به «Left-Step» را ارائه داد که بر مبنای قانون $$(n+l)$$ بنا شده بود. مفهوم این قانون در سال ۱۹۳۶ توسط «اروین مادلونگ» (Erwin Madelung) بیان شد و وی، پرشدن اوربیتالها را با این قانون توصیف کرد. در سال ۱۹۶۲، دانشمند روسی، «سیوولود کلاچکوفسکی» (Vsevolod Klechkovsky)، توضیحاتی علمی را برای این قانون با استفاده از «مدل توماس-فرمی» (Thomas–Fermi Model) ارائه داد.
ویژگی های اصلی در اصل آفبا
در ادامه، به بررسی ویژگیهای مهم در اصل آفبا میپردازیم.
- بر اساس اصل آفبا، الکترونها در ابتدا، اوربیتالهایی با کمترین انرژی را پر میکنند. این امر بدین معناست که الکترونها تنها زمانی به اوربیتالهایی با انرژی بالاتر وارد میشوند که اوربیتالهای با انرژی کمتر، به طور کامل پر شده باشند.
- با استفاده از قانون $$(n+l)$$، ترتیب افزایش انرژی اوربیتالها مشخص میشود. به عبارت دیگر، مجموع اعداد کوانتومی اصلی و فرعی، انرژی اوربیتال را مشخص میکند.
- مقادیر کمتر $$(n+l)$$، متناظر با انرژی پایینتر اوربیتال هستند. اگر دو اوربیتال، مقادیر یکسان از $$(n+l)$$ را داشته باشند، اوربیتالی با n کمتر، انرژی پایینتری دارد.
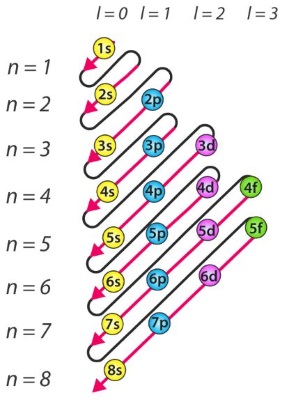
ترتیب پر شدن اوربیتالها به شرح زیر است:
$$1s\, 2s\, 2p\, 3s\, 3p\, 4s\, 3d\, 4p\, 5s\, 4d\, 5p\,\ 6s\, 4f\, 5d\, 6p\, 7s\, 5f\, 6d\, 7p\, ...$$
موارد استثنا در اصل آفبا
آرایش الکترونی عنصر کروم طبق اصل آفبا به صورت ناصحیح زیر خواهد بود:
$$ [Ar] 3d^4 4s^2$$
شکل صحیح آرایش الکترونی کروم به صورت زیر است:
$$ [Ar] 3d^5 4s^1$$
۲ عامل اصلی را برای این نوع آرایش الکترونی ذکر میکنند که در ادامه آمده است:
- پایداری بیشتر اوربیتال نیمهپر $$3d^5$$ نسبت به $$3d^4$$
- اختلاف کمتر انرژی بین زیرلایههای $$3d$$ و $$4s$$
اختلاف انرژی بین زیرلایههای مختلف در تصویر زیر آورده شده است.
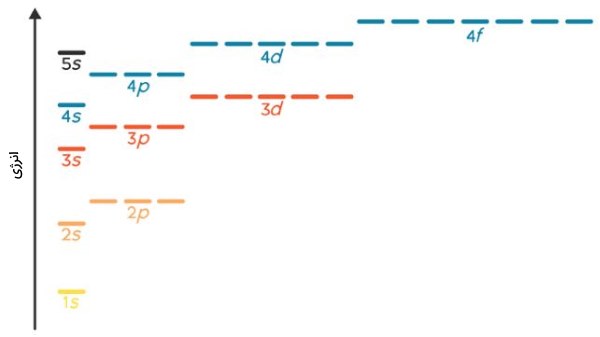
زیرلایههای نیمهپر، دافعه الکترونی کمتری را شامل میشوند و در نتیجه، پایداری را افزایش میدهند. به طور مشابه، زیرلایههایی که کامل پرشده باشند نیز موجب افزایش پایداری اتم میشوند. بنابراین، آرایش الکترونی برخی از اتمها از اصل آفبا پیروی نمیکند. از جمله این اتمها میتوان به کروم و مس اشاره کرد. شکل صحیح آرایش الکترونی اتم مس به صورت زیر است که این نوع آرایش را میتوان به کمک پایداری حاصل از اوربیتال پرشده $$3d$$ توصیف کرد.
$$ [Ar] 3d^{10} 4s^1$$
فلزات واسطه، لانتانیدها و اکتینیدها از اصل آفبا پیروی نمیکنند. عناصری که از اصل آفبا پیروی نمیکنند به صورت جدول در زیر آورده شدهاند. در این جدول، آرایش الکترونی مورد انتظار بر اساس این اصل و آرایش الکترونی اصلی (بر اساس مشاهدات آزمایشگاهی) مشخص شده است.
| عنصر | نماد | عدد اتمی | پیشبینی اصل آفبا | آرایش الکترونی اصلی |
| کروم | Cr | 24 | $${[\mathrm{Ar}] 4 \mathrm{s}^{2} 3 \mathrm{d}^{4}}$$ | $$[\mathrm{Ar}] 4 \mathrm{s}^{1} 3 \mathrm{d}^{5}$$ |
| مس | Cu | 29 | $${[\mathrm{Ar}] 4 \mathrm{s}^{2} 3 \mathrm{d}^{9}}$$ | $$[\mathrm{Ar}] 4 \mathrm{s}^{1} 3 \mathrm{d}^{10}$$ |
| نیوبیم | Nb | 41 | $${[\mathrm{Kr}] 5 \mathrm{s}^{2} 4 \mathrm{d}^{3}}$$ | $$[\mathrm{Kr}] 5 \mathrm{s}^{1} 4 \mathrm{d}^{4}$$ |
| مولیبدن | Mo | 42 | $${[\mathrm{Kr}] 5 \mathrm{s}^{2} 4 \mathrm{d}^{4}}$$ | $$[\mathrm{Kr}] 5 \mathrm{s}^{1} 4 \mathrm{d}^{5}$$ |
| روتنیم | Ru | 44 | $${[\mathrm{Kr}] 5 \mathrm{s}^{2} 4 \mathrm{d}^{6}}$$ | $$[\mathrm{Kr}] 5 \mathrm{s}^{1} 4 \mathrm{d}^{7}$$ |
| رودیم | Rh | 45 | $${[\mathrm{Kr}] 5 \mathrm{s}^{2} 4 \mathrm{d}^{7}}$$ | $$[\mathrm{Kr}] 5 \mathrm{s}^{1} 4 \mathrm{d}^{8}$$ |
| پالادیوم | Pd | 46 | $${[\mathrm{Kr}] 5 \mathrm{s}^{2} 4 \mathrm{d}^{8}}$$ | $$[\mathrm{Kr}] 4 \mathrm{d}^{10}$$ |
| نقره | Ag | 47 | $${[\mathrm{Kr}] 5 \mathrm{s}^{2} 4 \mathrm{d}^{9}} $$ | $$[\mathrm{Kr}] 5 \mathrm{s}^{1} 4 \mathrm{d}^{10}$$ |
| پلاتین | Pt | 78 | $${[\mathrm{Xe}] 6 \mathrm{s}^{2} 4 \mathrm{f}^{14} \mathrm{5d}^{8}}$$ | $$[\mathrm{Xe}] 6 \mathrm{s}^{1} 4 \mathrm{f}^{14} \mathrm{5d}^{9}$$ |
| طلا | Au | 79 | $${[\mathrm{Xe}]} 6 \mathrm{s}^{2} 4 \mathrm{f}^{14} \mathrm{5d}^{9}$$ | $$[\mathrm{Xe}] 6 \mathrm{s}^{1} 4 \mathrm{f}^{14} \mathrm{5d}^{10}$$ |
در هریک از عناصر بالا، اوربیتال d یک الکترون از اوربیتال s میگیرد. البته در خصوص پالادیوم، هر دو الکترون به اوربیتال d میرسند.
لانتانیدها و اکتینیدها
در لانتانیدها و اکتینیدها، ۱۰ عنصر از اصل آفبا پیروی نمیکنند که در جدول زیر آورده شدهاند.
| عنصر | نماد | عدد اتمی | پیشبینی اصل آفبا | آرایش الکترونی اصلی |
| لانتان | La | 57 | $$[\mathrm{Xe}] 6 \mathrm{s}^{2} 4 \mathrm{f}^{1}$$ | $$[\mathrm{Xe}] 6 \mathrm{s}^{2} \mathrm{5d}^{1}$$ |
| سریم | Ce | 58 | $$[\mathrm{Xe}] 6 \mathrm{s}^{2} 4 \mathrm{f}^{2}$$ | $$[\mathrm{Xe}] 6 \mathrm{s}^{2} 4 \mathrm{f}^{1} \mathrm{5d}^{1}$$ |
| گادولینیوم | Gd | 64 | $$[\mathrm{Xe}] 6 \mathrm{s}^{2} 4 \mathrm{f}^{8}$$ | $$[\mathrm{Xe}] 6 \mathrm{s}^{2} 4 \mathrm{f}^{7} \mathrm{5d}^{1}$$ |
| اکتینیوم | Ac | 89 | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{1}$$ | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 6 \mathrm{d}^{1}$$ |
| توریم | Th | 90 | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{2}$$ | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 6 \mathrm{d}^{2}$$ |
| پروتکتینیوم | Pa | 91 | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{3}$$ | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{2} 6 \mathrm{d}^{1}$$ |
| اورانیوم | U | 92 | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{4}$$ | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} \mathrm{\sf}^{3} 6 \mathrm{d}^{1}$$ |
| نپتونیم | Np | 93 | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{5}$$ | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{4} 6 \mathrm{d}^{1}$$ |
| کوریم | Cm | 96 | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{8}$$ | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{7} 6 \mathrm{d}^{1}$$ |
| لارنسیوم | Lr | 103 | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{14} 6 \mathrm{d}^{1}$$ | $$[\mathrm{Rn}] 7 \mathrm{s}^{2} 5 \mathrm{f}^{14} 7 \mathrm{p}^{1}$$ |
در تمامی موارد بالا، اوربیتال d، یک الکترون از اوربیتال f میگیرد. البته توریم و لارنسیوم قدری تفاوت دارند. در توریم، تمامی الکترونها به $$6d$$ میرسند و در لارنسیوم، $$6d$$ با $$7p$$ جایگزین میشود.
تناقض در ترتیب اوربیتالها
بسیاری از عناصر، از ترتیب پیشبینی شده اصل آفبا پیروی نمیکنند. همانطور که گفته شد، این روند را میتوان در فلزات واسطه، لانتانیدها و اکتینیدها مشاهده کرد. به طور مثال، اسکاندیم را در نظر بگیرید. آرایش الکترونی بر اساس اصل آفبا به صورت زیر است:
$$[Ar] 4s^2 3d^1$$
اما این آرایش با مشاهدات طیفسنجی تفاوت دارد. زمانیکه اتم اسکاندیم یونیزه میشود، فرض بر این است که الکترون از اوربیتال با بیشترین انرژی (در اینجا، اوربیتال $$3d$$) رها شود. با این وجود، این الکترون از اوربیتال $$4s$$ جدا خواهد شد تا با تشکیل $$Sc^+$$ به آرایش زیر برسد.
$$[Ar] 3d^1 4s^1$$
این آرایش نشان میدهد که اوربیتال $$3d$$ انرژی بیشتری نسبت به $$4s$$ دارد. چنین رفتاری را میتوان در فلزات واسطه نیز مشاهده کرد. روندی مشابه نیز در لانتانیدها و اکتینیدها وجود دارد. به طور مثال، آرایش الکترونی عنصر نئودیمیم بر اساس این اصل به صورت زیر خواهد بود:
$$[Xe] 6s^2 4f^4$$
اما ترتیب یونش و آرایش اصلی به شکل زیر است:
$$ [Xe] 4f^4 6s^2$$
اثر نسبیت
برای هستههای سنگینتر $$(Z ≥ 120)$$، این اصل، درستی خود را از دست میدهد. با افزایش بار هسته، الکترونها، بویژه آنهایی که نزدیک هسته قرار دارند، نیروی الکترواستاتیک شدیدی را متحمل میشوند. الکترونهای چنین هستهای، سرعتی نزدیک به سرعت نور دارند. بنابراین، باید نظریه نسبیت را نیز در این خصوص در نظر بگیریم.
دلیل وجود استثنا
پیشتر بیان کردیم که این اصل، موارد استثنا را شامل میشود اما دلیل وجود این موارد در چیست. در حقیقت، این سوال پیش میآید که آیا قانون بهتری در این خصوص وجود دارد. در پاسخ باید گفت خیر. هیچ رابطه ساده ریاضی وجود ندارد که این آرایش الکترونی را توصیف کند. در یک اتم، دو برهمکنش الکترواستاتیکی داریم:
- جاذبه بین هسته مثبت و الکترونهای منفی
- دافعه بین الکترونها
هر اتم یا یون تلاش میکند تا میزان دافعه را کاهش دهد تا به آرایشی با کمترین میزان انرژی دست پیدا کند و فهم چنین سیستمی بسیار پیچیده است.
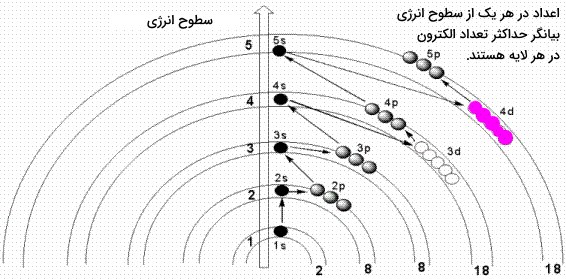
مثال استفاده از اصل آفبا
همانطور که گفته شد، از اصل آفبا برای پیدا کردن و نمایش صحیح آرایش الکترونی عناصر استفاده میکنند. در ادامه به کمک مثالهایی، آرایش الکترونی برخی از عناصر را بررسی میکنیم.
مثال آرایش الکترونی گوگرد
برای اینکه به آرایش الکترونی گوگرد برسیم، باید توجه کنیم که عدد اتمی این عنصر برابر با ۱۶ است به این معنی که این عنصر در مجموع ۱۶ الکترون خواهد داشت. بر اساس اصل آفبا، دو الکترون در اوربیتال $$1s$$ و ۸ الکترون در اوربیتالهای $$2s$$ و $$2p$$ قرار دارند. مابقی الکترونها نیز متعلق به زیرلایهها (اوربیتالهای فرعی) $$3s$$ و $$3p$$ هستند. بنابراین، آرایش الکترونی گوگرد به صورت زیر خواهد بود:
$$ 1s^2 2s^2 2p^6 3s^2 3 p ^4$$
مثال آرایش الکترونی نیتروژن
عنصر نیتروژن با توجه به عدد اتمی ۷، دارای ۷ الکترون است. این الکترونها در اوربیتالهای $$1s$$، $$2s$$ و $$2p$$ قرار میگیرند. در نتیجه، آرایش الکترونی نیتروژن به صورت زیر خواهد بود:
$$ 1s^2 2s^2 2p^3 $$
آموزش اصل آفبا
در ابتدای متن، توضیح مختصری در خصوص اصل آفبا ارائه دادیم اما در ادامه قصد داریم تا توصیف دقیقتری از این اصل داشته باشیم. همانطور که گفته شد، اصل آفبا بیان میکند که در ابتدا، اوربیتالهایی با سطح انرژی پایینتر و پیش از اوربیتالها با انرژی بیشتر، پر میشوند.
نحوه پرشدن این اوربیتالها در تصویر ابتدای متن، نمایش داده شد اما نگاهی دقیقتر به این نمودار خواهیم داشت.
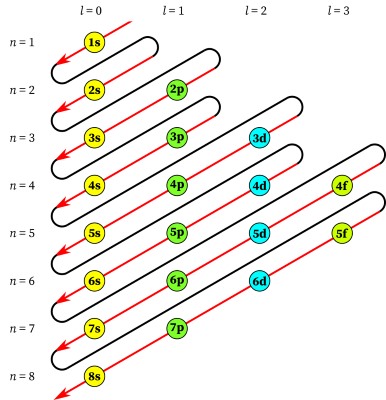
در تصویر بالا، اوربیتالهای همنوع با یک رنگ نشان داده شده و به ترتیب عدد کوانتومی اصلی، مرتب شدهاند. از چپ به راست، ترتیب اوربیتالها بر اساس عدد کوانتومی اصلی (l) تنظیم شده است. $$l = 0$$ متناظر با اوربیتال s و به همین ترتیب، اعداد کوانتومی ۲،۱ و ۳ متناظر با اوربیتالهای d، p و f هستند.
ترتیب پر شدن اوربیتالها با اوربیتال $$1s$$ شروع میشود که کوچکترین اوربیتال با کمترین میزان انرژی است. بنابراین، اولین الکترون به این اوربیتال وارد میشود و آرایش الکترونی اتم هیدروژن یعنی $$1s^1$$ را تشکیل میدهد. در ادامه، الکترون دوم به اوربیتال $$1s$$ وارد و آرایش الکترونی گاز نجیب هلیوم، یعنی $$1s^2$$ تشکیل میشود. هر الکترونی که اضافه شود، عدد اتمی به میزان ۱ واحد افزایش مییابد زیرا همراه با افزایش الکترون، به تعداد پروتون نیز افزوده خواهد شد.
بعد از اینکه اوربیتال $$1s$$ به طور کامل پر شد، الکترون سوم وارد اوربیتال $$2s$$ خواهد شد و آرایش الکترونی متناظر با اتم لیتیوم به صورت $$ 1s^2 2s^1$$ تشکیل میشود که این اتم در جدول تناوبی، درست در پایین هیدروژن قرار دارد. به طور مشابه نیز اتم برلیم با آرایش الکترونی $$ 1s^2 2s^2$$ خواهیم داشت. بعد از پر شدن اوربیتال $$2s$$، نوبت به سایر اوربیتالها میرسد.
فرمول اصل آفبا و قانون مادلونگ
سوالی که در اینجا پیش میآید این است که نحوه پرشدن اوربیتالها بر اساس چه رابطه و فرمولی انجام میشود. در حقیقت، فرمولی برای این منظور نیست اما منطق مشخصی پشت اصل آفبا وجود دارد که به قانون $$n+l$$ معروف است. انرژی یک اوربیتال به طور عمده از دو عدد کوانتومی اصلی و فرعی تاثیر میگیرد. عدد کوانتومی اصلی، متناظر با لایه اصلی و عدد کوانتومی فرعی، متناظر با زیرلایهها است. با افزایش مقدار این دو عدد، انرژی یک اوربیتال نیز افزایش پیدا میکند. برای توصیف این ارتباط از قانون $$n+l$$، موسوم به «قانون مادلونگ» (Madelung Rule) است.
قانون مادلونگ به احترام دانشمند آلمانی، «اروین مادلونگ» (Erwin Madelung) نامگذاری شده است. این قانون دو مورد زیر را بیان میکند:
- الکترونها در یک اتم، اوربیتال را با کمترین مقدار $$n+l$$ پر میکنند.
- زمانیکه دو اوربیتال یا بیشتر، مقادیر یکسانی از $$n+l$$ داشته باشند، الکترون، اوربیتال با مقدار کمتر n را اشغال میکند.
جدول تناوبی و اصل آفبا
همانطور که میدانید، در جدول تناوبی عناصر شیمیایی، عنصرها بر اساس عدد اتمی مرتب میشوند. از آنجایی که افزایش عدد اتمی، متناظر با افزایش تعداد الکترونها خواهد بود، آرایشهای الکترونی در هر تناوب و گروه جدول تناوبی، وجه اشتراک مشخصی دارد. قوانینی همچون اصل طرد پائولی، اصل آفبا و قواعد هوند برای تعیین آرایش دقیق الکترونها مورد استفاده قرار میگیرند.
فهم دقیق اصول گفته شده در بالا به درک صحیحی از نحوه آرایش الکترونی عناصر در جدول تناوبی کمک میکند. به عبارت دیگر، نحوه تشکیل جدول تناوبی به طور مستقیم به آرایش الکترونی وابسته است. بعد از مطالعاتی که بر روی ارتباط بین آرایش الکترونی و جدول تناوبی انجام شد، نیلز بور نشان داد آرایش الکترونی برای عناصر همگروه در جدول تناوبی با یکدیگر مشابه است.
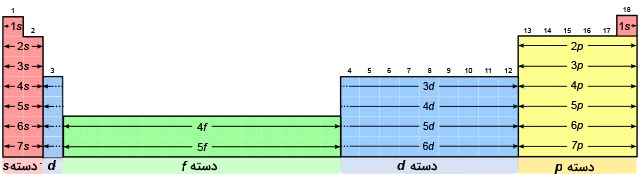
دسته های جدول تناوبی
در ادامه به بررسی دستهها (بلوکها) در جدول تناوبی و ارتباط آنها با اصل آفبا میپردازیم.
- دسته s: دسته s در جدول تناوبی عناصر شامل فلزات قلیایی و قلیایی خاکی است که به ترتیب با نام گروههای ۱ و ۲ شناخته میشوند. هلیوم نیز بخشی از دسته s را تشکیل میدهد. عدد کوانتومی اصلی یعنی n، اوربیتال s این گروه از فلزات را تشکیل میدهد که در نهایت، تعداد ۲ الکترون میتواند این اوربیتال را پر کنند.
- دسته p: دسته p شامل گروههای ۱۳، ۱۴، ۱۵، ۱۶، ۱۷ و ۱۸ به غیر از هلیوم است. عدد کوانتومی اصلی، تشکیلدهنده اوربیتال p خواهد بود و در هر اوربیتال p در نهایت، ۶ الکترون جای میگیرند.
- دسته d: عناصر دسته d را میتوان در گروههای ۳، ۴، ۵، ۶، ۷، ۸، ۹، ۱۰، ۱۱ و ۱۲ از جدول پیدا کرد. عناصر این دسته را همچنین با نام عناصر واسطه میشناسند. اوربیتال d در این دسته با لایه الکترونی «$$n-1$$» پر میشود و در هر اوربیتال، ۱۰ الکترون جای میگیرد.
- دسته f: عناصر دسته f، لانتانیدها و اکتینیدها هستند. اوربیتالهای f لایهها با عدد «$$n-2$$» پر میشوند و هرکدام میتوانند ۱۴ الکترون را در خود جای دهند.
محدودیت های اصل بناگذاری آفبا
اصل آفبا بر این اساس بنا شده است که ترتیب انرژیهای اوربیتالها، ترتیبی ثابت است. چنین فرضی برای بکارگیری این اصل، صحیح به نظر میرسد اما به لحاظ فیزیکی ممکن است درست نباشد. اصل بناگذاری آفبا اوربیتالها را به صورت جعبههایی با انرژی ثابت در نظر میگیرد که در نهایت، هرکدام میتوانند دو الکترون را در خود جای دهند درصورتیکه انرژی یک الکترون در اوربیتال اتمی به انرژی تمامی الکترونهای موجود در اتم وابسته است.
در اتمی شبیه به هیدروژن که یک الکترون داشته باشد، اوربیتالهای s و p در اصل آفبا، هردو به یک میزان انرژی دارند. در صورتیکه در اتم هیدروژن واقعی، سطوح انرژی، توسط میدان مغناطیسی هسته، قدری از یکدیگر متفاوت هستند. از آنجایی که هر اتم، تعداد متفاوتی پروتون در هسته خود دارد، میدان مغناطیسی آنها نیز متفاوت خوهد بود که سبب تغییر میزان کشش در هر الکترون میشود.
به طور کلی، اصل بناگذاری آفبا برای حالت پایه ۱۸ عنصر اول در جدول تناوبی به خوبی عمل میکند و در ادامه، کارایی آن کاهش مییابد.











سلام خوب بود مرس
فقط آرایش الکترونی گوگرد رو اصلاح کنید
با سلام؛
از ارائه بازخورد شما بسیار سپاسگزاریم. متن بازبینی و به طور مجدد اصلاح شد.