اثر دما بر انحلال پذیری چیست؟ — به زبان ساده
اثر دما بر انحلال پذیری از مهمترین پارامترهای تأثیرگذار در فرایند انحلالپذیری است. دما میتواند موجب افزایش یا کاهش مقدار ماده حلشونده در حلال شود. ماده حلشونده میتواند به شکل گاز، جامد یا مایع باشد. در بیشتر جامدات، با افزایش دما و در گازها با کاهش دما انحلالپذیری افزایش پیدا میکند. همچنین در پایان این مطلب با مفهوم انحلالپذیری آشنایی بیشتری پیدا میکنید.
دما چه تاثیری بر انحلال پذیری دارد؟
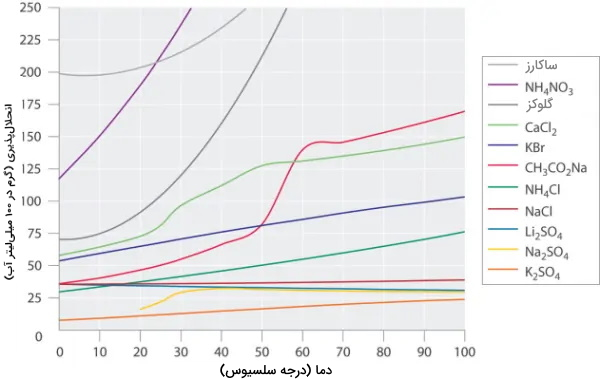
در شکل زیر انحلالپذیری چند ماده آلی و معدنی در آب نشان داده شده است، با توجه به شکل میتوان دریافت که دما بر هر ماده تأثیر متفاوتی دارد. انحلالپذیری گلوکز و $$CH_3CO_2Na$$ با افزایش دما به طور چشمگیری افزایش پیدا کرده درحالیکه برای سولفات لیتیوم $$(Li_2SO_2)$$ شرایط کاملاً متفاوت است و افزایش دما موجب کاهش انحلالپذیری آن در آب شده است.
از طرفی، انحلالپذیری برخی مواد مانند سولفات پتاسیم $$(K_2SO_4)$$ و نمک خوراکی $$(NaCl)$$ چندان تحت تأثیر افزایش دما نیستند. هیچ رابطه معناداری بین نوع ساختار و انحلالپذیری مواد وجود ندارد.
اثر دما بر انحلال پذیری جامدات چیست؟
در بیشتر جامدات، افزایش دما موجب افزایش انحلالپذیری آنها میشود و کاهش دما با کاهش انحلالپذیری همراه است. در این بین استثنا نیز وجود دارد. افزایش دما موجب افزایش حرکت مولکولهای حلال و در نتیجه، برهمکنش بیشتر با مولکولهای ماده حلشونده میشود و حل شدن جامدات را افزایش میدهد.
بر اساس اصل لوشاتلیه، هر عاملی از جمله دما که موجب تعادل سیستم شود، سیستم برای بیاثر کردن آن تغییر و حفظ پایداری، با تغییر اعمال شده مقابله میکند.تاثیر دما بر انحلالپذیری میتواند به گرماده و گرماگیر بودن واکنش بستگی داشته باشد.
- در فرایند گرماگیر افزایش دما موجب میشود تعادل سیستم به سمت تولید فراورده میل پیدا کند، یعنی باعث میشود واکنشدهنده بیشتری مصرف شود. در این بین، بخشی از دما صرف فرایند انحلالپذیری میشود و بدون اینکه تغییری در تعادل رخ دهد افزایش دما با افزایش انحلالپذیری همراه است.
- اما اگر فرایند گرماده باشد، افزایش دما تعادل را به سمت چپ هدایت میکند یعنی با کاهش مصرف واکنشدهنده یا کاهش انحلالپذیری همراه است.
تاثیر واکنش های گرماده و گرماگیر
گرماده و گرماگیر بودن واکنش، روی اثر دما بر انحلال پذیری موثر است. در واکنشهای گرماگیر با افزایش دما و در واکنشهای گرماده با کاهش دما انحلالپذیری افزایش پیدا میکند.
- تعریف واکنش گرماگیر: میزان گرمای تولید شده هنگام انحلال، کمتر از انرژی لازم برای شکستن پیوند ساختار ماده حلشونده است. واکنش آمونیوم نیترات $$(NH_4NO_3)$$ در هنگام فعالسازی کیسه آب سرد نمونهای از واکنش گرماگیر است.
- تعریف واکنش گرماده: میزان گرمای تولید شده هنگام انحلال، بیشتر از انرژی لازم برای شکستن پیوندها در ماده حلشونده است. واکنش سدیم استات در کیسههای آب گرم واکنشی گرماده است.

تاثیر تغییرات آنتالپی بر انحلال پذیری
آنتالپی انحلالپذیری تفاوت گرمای محلول، پیش و پس از حل شدن ماده در حلال است. در حقیقت، آنتالپی انحلالپذیری به گرمای جذب یا آزاد شده در فشار ثابت اشاره دارد. آنتالپی انحلالپذیری میتواند مقداری مثبت یا منفی داشته باشد. مقدار مثبت به معنی گرماگیر بودن واکنش و منفی بودنش یعنی اینکه واکنش گرمازاست.
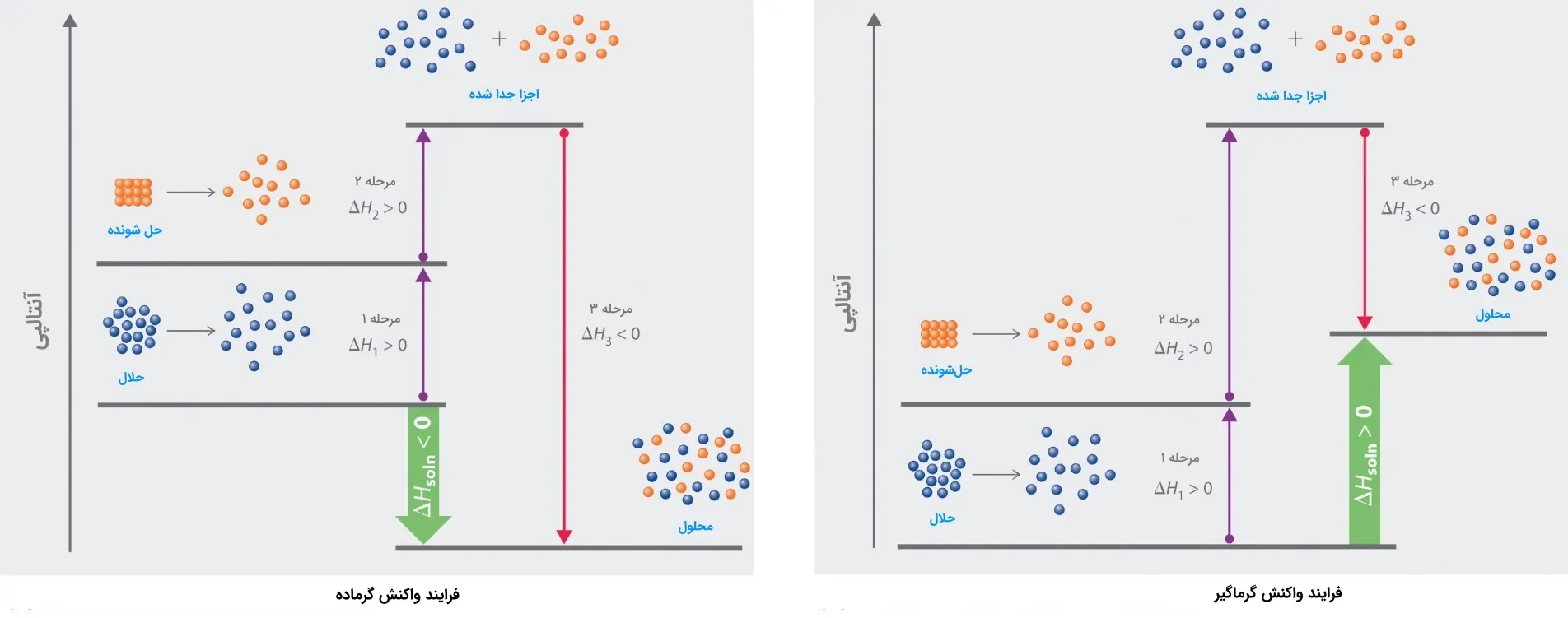
حل شدن ماده در حلال شامل سه مرحله است که در زیر فهرست شدهاند. هر مرحله آنتالپی جداگانهای دارد.
- مرحله اول: مولکولهای حلال از یکدیگر جدا میشوند. در این مرحله بعد از ضعیف شدن نیروهای بینمولکولیِ حلال، پیوندها شکسته میشوند. شکسته شدن پیوند به انرژی نیاز دارد و فرایندی گرماگیر است؛ آنتالپی در این مرحله مثبت $$(\triangle H_1>0)$$ است.
- مرحله دوم: مولکولهای ماده حلشونده از یکدیگر جدا میشوند. در این مرحله نیز مشابه مرحله نخست، آنتالپی مثبت $$(\triangle H_2>0)$$ است.
- مرحله سوم: شامل به هم پیوستن مولکولهای حلال و ماده حلشونده است. در این مرحله با ترکیب اجزای جدا شده در مرحله اول و دوم گرما آزاد میشود و آنتالپی در این مرحله منفی $$\triangle H_3<0$$ است.
آنتالپی انحلالپذیری، از مجموع سه معادله زیر بهدست میآید.
$$\triangle H_{solution}=\triangle H_1+\triangle H_2+\triangle H_3$$
تاثیر تغییرات آنتالپی به عنوان یک تابع حالت در ترمودینامیک و دما بر انحلالپذیری به شرح زیر است:
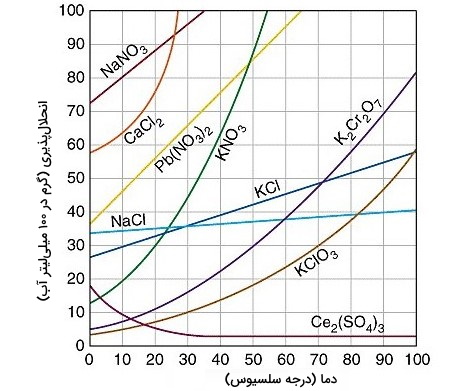
- $$\triangle H\geq0$$: وقتی $$\triangle H$$ در این حالت، واکنشی گرماگیر داریم که با افزایش دما، انحلالپذیری نیز افزایش مییابد. انحلالپذیری نمکهایی چون نیترات باریم $$(Ba(NO_3)_2)$$ و آرسنات سدیم $$(Na_3AsO_4)$$ در آب چنین شرایطی دارند.
- $$\triangle H\approx0$$: در این حالت، افزایش یا کاهش دما تاثیر چندانی بر انحلالپذیری ماده مورد نظر ندارد. انحلالپذیری سدیم کلرید در آب چندان تحت تاثیر دما نیست.
- $$\triangle H<0$$: در این حالت، واکنش گرماده و با افزایش دما انحلالپذیری کاهش مییابد. موادی چون کلسیم سولفات $$(CaSO_4)$$، سریم (III) سولفات $$Ce_2(SO_4)_3$$ و کلسیم هیدروکسید $$(Ca(OH)_2)$$ با آب نمونههایی از این دست مواد هستند.
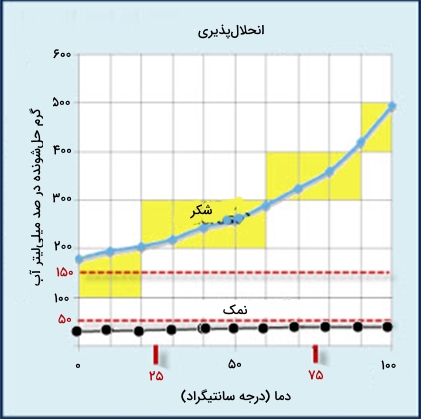
اثر دما بر انحلال پذیری نمک ها
در مثالی دیگر از جامدات، میتوان به نمک خوراکی به عنوان جامد یونی اشاره کرد. جامدات یونی بهواسطه وجود یونهای مثبت و منفی، پیوند یونی دارند.
هنگام حل شدن جامدات یونی در حلالی چون آب، این مواد یونهای مثبت و منفی تجزیه میشود. اگر انرژی حاصل از برهمکنش نمک و آب بیشتر از انرژی لازم برای شکستن پیوندهای یونی و جداسازی مولکولهای آب باشد حل شدن رخ میدهد.
جامدات مولکولی مانند شکر بهواسطه نیروهایی ضعیف بینمولکولی در کنار هم نگه داشته شدهاند. حل شدن شکر در آب با از بین رفتن پیوندهای بینمولکولی آن همراه است، که سبب از بین رفتن ساختار شکر و حضور آن در محلول به صورت مولکوهای $$C_{12}H_{22}O_{11}$$ باشد.
انرژی لازم برای شکسته شدن ساختار شکر بهوسیله پیوندهای قطبی بین مولکولهای آب و شکر تأمین میشود. در هر لیتر آب نزدیک به ۱۸۰۰ گرم ساکارز حل میشود. افزایش دما باعث افزایش انحلالپذیری شکر میشود اما تأثیر چندانی بر انحلالپذیری نمک ندارد.
اثر دما بر انحلال پذیری گازها
مولکولها در فاز گازی با یکدیگر برهمکنشی ندارند، وقتی گازها وارد فاز مایع میشوند با مولکولهای مایع برهمکنش دارند که این برخوردها موجب آزاد شدن گرما میشود. از اینرو، انحلال بیشتر گازها در در مایعات فرایندی گرماده یعنی $$ΔH_{soln}<0$$ است.
به طور معمول دما و انحلالپذیری گازها با یکدیگر رابطه عکس دارند. یعنی هرچه دما افزایش یابد انحلالپذیری کم میشود و با کاهش دما، شاهد افزایش انحلالپذیری گازها هستیم. طبق نظریه جنبشی، افزایش دما باعث افزایش انرژی جنبشی و در نتیجه، افزایش تحرک مولکولهای گاز میشود.
بیشتر شدن حرکت مولکولها باعث شکسته شدن پیوندهای بین مولکولی و فرار آنها از محلول میشود. گازهایی چون هیدروژن کلرید یا آمونیاک به راحتی در آب حل میشوند، درحالیکه حل شدن اکسیژن در آب بهسختی صورت میگیرد.
انحلال گازها در مایعات واکنشی گرماده به شمار میآید، پس طبق اصل لوشاتلیه برای حفظ پایداری سیستم، کاهش دما با افزایش مصرف واکنشدهنده همراه است.
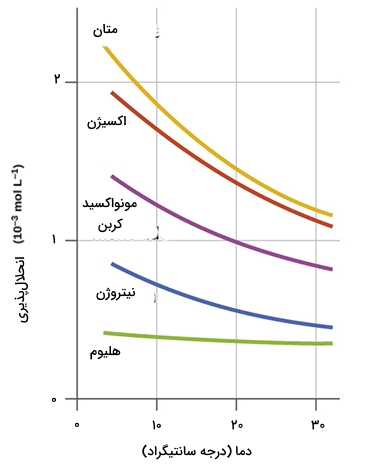
اثر دما بر انحلال پذیری گازها در آب چیست؟
کاهش انحلالپذیری گازها در دماهای بالاتر، هم پیامدهای کاربردی و هم زیستمحیطی دارد. کاهش سطح اکسیژن در زیستگاه آبزیان و تشکیل رسوب در لوله و دیگهای بخار صنعتی میتواند آثار مخربی داشته باشد.
علت تشکیل رسوب در کتری
وجود یونهایی فراوانی چون $$Ca_2^+$$ و $$HCO_3^-$$ در آب دلیل سختی آب است. کلسیم بیکربنات $$Ca(HCO_3)_2$$ در آب حل میشود درحالیکه کلسیم کربنات یا سنگ آهک $$(CaCO_3)$$ به صورت نامحلول رسوب میکند. بیکربنات میتواند در محلول به صورت دیاکسید کربن، یون کربنات و آب تجزیه شود.
$$2HCO_3^−(aq) → CO_2^{{2−}}(aq) + H_2O(l) + CO_2(aq)$$
افزایش دمای آب باعث میشود که انحلالپذیری $$CO_2$$ کاهش یابد و به شکل گاز از محلول خارج شود و یون کربنات به صورت $$CaCO_3$$ رسوب کند.

اثر دما بر انحلال پذیری مایعات
مایعات بر اساس قطبی یا ناقطبی بودن با نسبتهای مختلفی با یکدیگر مخلوط میشوند. حل شدن مایعاتِ مشابه، طبق قانون «شبیه، شبیه را در خود حل میکند» انجام میشود. اتانول، سولفوریک اسید و اتیلن گلیکول $$(C_2H_6O_2)$$ به هر نسبتی در آب حل میشوند و امتزاجپذیر هستند.
روغن موتور و بنزین نیز به نسبتهای مختلفی میتوانند با یکدیگر مخلوط شوند. بنزین، روغن، تتراکلرید کربن و برخی رنگها که مایعاتی ناقطبی هستند در آب حل نمیشوند. انحلالپذیری ترکیبات آلی در آب نسبت مستقیمی با افزایش دما دارد.
در مایعات امتزاجپذیر به شکل محلول، جاذبه بین مولکولی حلال و حلشونده قویتر از زمانی است که به صورت خلاص هستند. در تعریف ساده، به مایعاتی با شرایط زیر امتزاجناپذیر می گوییم:
- به هم شبیه نباشند.
- قطبیت متفاوتی داشته باشند.
- در یکدیگر حل نشوند.

انحلال پذیری چیست؟
اکنون با آگاهی از تاثیر دما بر انحلالپذیری بهتر با مفهوم انحلالپذیری آشنا شویم. انحلالپذیری فرایند حلشدن ماده حلشونده در حلال است.
بیشترین مقداری که ماده حلشونده در یک دمای معین میتواند در حلال حل شود، حلالیت تعریف میشود. میزان حل شدن ماده در حلال به عوامل زیر بستگی دارد.
- دما
- فشار
- قطبیت
- اندازه ذرات ماده حلشونده
- حضور دیگر گونهها
نامحلول، مادهای است که میزان حلالیت آن کمتر از ۰/۱ گرم در ۱۰۰ میلیلیتر باشد. با افزایش دما انحلال مواد جامد یا مایع کممحلول و نامحلول ممکن میشود. بر اساس مقدار ماده حلشونده در حلال، مواد به سه دسته زیر تقسیم میشوند.
- محلول
- کممحلول
- نامحلول
اثر دما بر انحلال پذیری چه کاربردی دارد؟
اثر دما بر انحلال پذیری در تبلور جزء به جزء و خالصسازی مواد و همچنین صنعت نوشیدنیهای گازدار کاربرد دارد.
روش جداسازی تبلور جزء به جزء چیست؟
اساس فرایند خالصسازی در تبلور جزء به جزء، تفاوت در انحلالپذیری اجزای تشکیلدهنده مخلوط است. هر چه این تفاوت بیشتر باشد تعداد مراحل جداسازی کمتر خواهد بود و روند خالصسازی با سرعت بیشتری صورت میگیرد.
در این فرایند، در دمای مشخصی مخلوط در حلال حل میشود. جزئی که در آن دما، انحلالپذیری کمتری دارد هنگام «تبلور» (Crystallization) درصد بیشتری از رسوب را تشکیل میدهد. اگر انحلالپذیری دو جز نزدیک به هم باشد برای جداسازی کامل از «فرایند پیدرپی/آبشاری» (Cascade Process) استفاده میکنند. شیمیدانان از این روش برای بازیافت مواد یا بهدست آوردن مواد با خلوص بالا استفاده میکنند. تهیه عناصر کمیاب و جداسازی لانتانیدها با استفاده از این روش انجام میشود.

اثر دما بر انحلال پذیری گازها در پرورش ماهی
با افزایش دما، انحلالپذیری گازها در آب کاهش پیدا میکند. افزایش دمای آب رودخانهها، دریاچهها یا محل زیست ماهیان، انحلالپذیری گاز اکسیژن را کاهش میدهد و باعث میشود که سطح اکسیژن در آب پایین بیاید. کاهش سطح اکسیژن در آب منجر به مرگ و میر آبزیان از جمله ماهیها میشود. از اینرو، کنترل صحیح دمای آب، خاصه برای پرورش ماهی، اهمیت بالایی دارد.

اثر دما بر انحلال پذیری گازها در صنعت نوشابه سازی
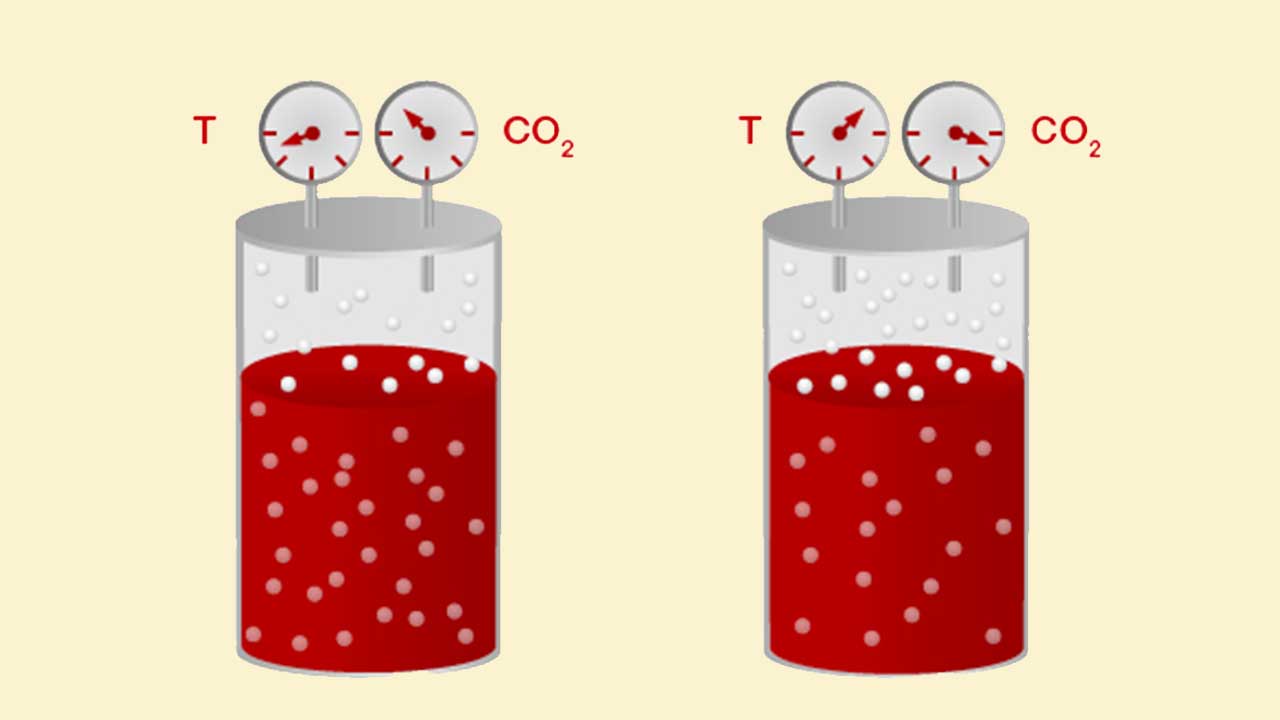
در صنعت نوشابهسازی برای گازدار کردن نوشیدنیها از گاز دیاکسید کربن در فشار بالا استفاده میشود. ایجاد حباب در نوشابه، به دلیل وجود این گاز است و هر چه میزان گاز در نوشابه بیشتر باشد به همان اندازه نوشیدنی گازدارتر میشود. برای حل کردن دیاکسید کربن در مایعات، از فشار بالا و دمای پایین استفاده میشود.
در این فرایند با کنترل دما میتوانند میزان گاز دیاکسید کربن در نوشابه را کنترل کنند. به دلیل رابطه معکوس دما و انحلالپذیری برای حفظ دیاکسید کربن، نوشیدنیهای گازدار در دماهای پایین نگهداری میشوند. انحلالپذیری گازهایی مانند آمونیاک، دیاکسید گوگرد و هیدروژن کلرید نیز با کاهش دما، افزایش پیدا میکند.

نتیجه گیری اثر دما بر انحلال پذیری
در این مطلب با اثر دما بر انحلالپذیری گازها، جامدات و مایعات آشنا شدید. هماهنطور که بالاتر اشاره شد با توجه به نوع ماده حلشونده، دما میتواند بر انحلالپذیری تاثیر زیادی داشته باشد. افزایش دما و کاهش میزان سطح اکسیژن در آب میتواند آثار مخربی ایجاد کند. آنتالپی انحلالپذیری، گرماگیر یا گرماده بودن فرایند را مشخص میکند و تاثیر دما بر واکنش را نشان میدهد.
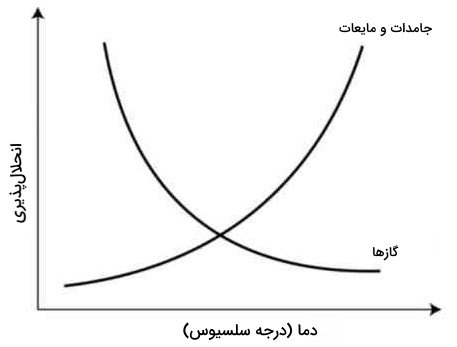
به طور کلی افزایش دما در جامدات با افزایش انحلالپذیری همراه است و در گازها با کاهش دما انحلالپذیری افزایش پیدا میکند.











سلام. خسته نباشید
میتونید یک توضیحی درباره این سوال بدهید:؟
میزان انحلال پذیری کدام یک از موارد با افزایش دما متفاوت است؟
گوگرد، اکسیژن، کات کبود، الکل
(سوال تستی)
با سلام؛
با توجه به ماهیت ماده (از نظر جامد و مایع و گاز) باید بررسی کنید که در داخل متن به طور کامل توضیح داده شده است.
با تشکر از همراهی شما با مجله فرادرس
سلام من به یک ماده یا گاز یا عنصری نیاز دارم که در یک محفظه بسته باافزایش دما فشار زیادی ایجاد کنه و با کاهش دما برگرده به حالت قبل با فشار کم ممنون میشم کمکم کنید
سلام
فرق سلیسوس و سانتی گراد چیه؟؟
داش فرقی ندارد سلسیوس با سانتی گراد